Rose trémière : elle a tout d’une mauve
Alcea rosea
La rose trémière est devenue une incontournable des jardins pour le plus grand plaisir des butineurs ! Elle s’est imposée dans nombre paysages urbains qu’elle structure de ses immenses hampes florales comme les rues des villages du littoral atlantique : façades blanches, volets bleus et roses trémières … la carte postale rêvée ! Si vous avez la chance d’avoir un jardin et qu’elle ne s’y trouve pas, ne tardez plus à l’y installer car le spectacle de sa floraison opulente et continue et de ses fleurs somptueuses en vaut largement la peine. La taille de ses fleurs en fait justement un bel outil pour une leçon d’anatomie florale d’autant qu’elle représente, pour partie, une famille riche en espèces sauvages, les Malvacées aux fleurs riches en singularités.
Elle n’a rien d’une rose !
Malvacées vous avez dit et pas Rosacées ? Pourtant, cette plante porte une foule de noms populaires autour de la rose : rose papale, rose de Damas, rose de mer, primerose et passe-rose. Ces deux derniers surnoms donnent la clé de cette fixation sur la rose : cette plante introduite s’est imposée comme ornementale à partir du 16ème et on disait d’elle alors que la beauté de sa fleur surpassait celle de la rose d’où passe-rose (ou qu’elle primait sur la rose) ! Comme par ailleurs ses origines restent entachées d’un certain mystère (probablement de l’Est du bassin méditerranéen par hybridation d’espèces locales ou peut être de Chine), on l’a toujours assimilée à une plante exotique venue d’outre-mer d’où un autre surnom, celui de rose « d’oustre mer » qui s’est déformé en trémière au 17ème siècle, adjectif qui n’a aucun sens en dehors de cette association avec cette plante ! Donc, le verdict est sans appel : la rose trémière n’est pas une rose ; elle n’en partage que la beauté et c’est très bien !
La famille des mauves
La rose trémière s’apparente en fait un ensemble de plantes à fleurs dont certains genres nous sont bien familiers soit comme espèces indigènes, soit comme ornementales : guimauves, mauves, lavatères, malopes, hibiscus, abutilons, ketmies, sidalcées, anodes, … qui partagent toutes des fleurs avec une structure bien particulière notamment au niveau des étamines et du pistil. On les regroupe dans la famille des Malvacées (de Malva, nom latin des mauves). Cependant, dans la classification moderne par parentés, la famille des Malvacées a connu de profonds remaniements et on y a adjoint d’autres petites familles de l’ancienne classification dont les Bombacacées (baobabs), les Tiliacées (tilleuls) ou les sterculiacées (Cacaoyer ou noix de cola) et d’autres. Dans ce vaste ensemble très hétérogène du point de vue de l’apparence externe (mais pas en termes de parentés !), on distingue donc neuf sous-familles dont celle des Malvoïdées qui correspond en gros à l’ancienne version de la famille des Malvacées. Même dans ce groupe plus restreint, il règne encore de la diversité si bien qu’on y distingue quatre tribus dont les cotons et ketmies, les hibiscus et les mauves et guimauves. La rose trémière ne représente donc en fait que cette dernière tribu à travers la structure de sa fleur et encore avec des variations entre genres.
- Trois espèces de Malvacées qui ne font partie de la tribu des mauves : les abutilons …
- .. la mauve en arbre qui est en fait un hibiscus ; noter la colonne staminale centrale typique.
- … et l’hibiscus musqué qui recherche la proximité de l’eau
Eh oui, il n’existe pas de type défini, juste des caractères partagés : donc la rose trémière a tout d’une mauve mais ce n’est pas une mauve au sens strict !
- Six genres de la tribu des mauves : Anoda (anode)
- Guimauve (Althaea)
- Mauve (Malva)
- Malope (Malope)
- Sida (Sida)
- Spheralcea
Géante
Voyons donc les originalités de cette fleur si facile à observer, presque sans avoir besoin de recourir à la loupe à main pour en observer les détails. En effet, la rose trémière se démarque par sa taille : une tige robuste qui monte en moyenne à 2-3m mais peut atteindre … plus de 7 mètres ! Elle n’accède à cette taille qu’à partir de sa seconde année après une première année passée à élaborer surtout une rosette de feuilles volumineuse et éventuellement une petite inflorescence. Elle se comporte au minimum comme une bisannuelle, la plante mourant après sa seconde floraison mais, le plus souvent, elle peut vivre plusieurs années consécutives ; on peut parler de vivace à brève longévité.
- Devant un bâtiment, les roses trémières « assurent » par leur taille remarquable
- La longue inflorescence toute dressée
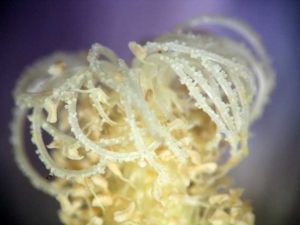
- La floraison se fait progressivement depuis le bas vers le haut ; la femelle apion choisit les boutons au milieu d e l’inflorescence, ceux qui mettront deux semaines à s’ouvrir.
Près de la moitié de la plante adulte est occupée par l’inflorescence composée de trente à cinquante boutons floraux (beaucoup moins nombreux et tout petits la première année) qui vont fleurir du bas vers le haut progressivement ce qui donne une saison de floraison étalée sur plusieurs mois. A partir de la seconde et de la troisième année, la hauteur de l’inflorescence atteint souvent près de deux mètres à elle seule. Cette production abondante de fleurs sur une longue période en fait une plante intéressante pour les butineurs qui la visitent ; elle conserve ce pouvoir attractif jusqu’à l’entrée de l’automne.
Double calice
En attendant la belle floraison, concentrons nous sur les boutons floraux volumineux qui jalonnent l’inflorescence. L’aspect hérissé saute aux yeux : à la loupe, on note des soies raides transparentes formant une forêt dense très dissuasive envers les herbivores de petite taille du style chenilles ; les tiges portent elles aussi des poils mais qui sont par contre étoilés et moins proéminents.
- Boutons floraux hérissés de soies raides et protégés par les sépales repliés
- Sépales en coupe : noter leur épaisseur et le revêtement dissuasif de soies raides
- De profil, on note le calicule externe plaqué sur le calice plus grand, lui-même appliqué contre les pétales
- Le double calice protège les organes reproducteurs (la partie la plus précieuse de la fleur) contre les attaques des herbivores ; ces gendarmes cherchent à percer le calice pour sucer les substances nutritives contenues dans les ovules situés derrière
Autre surprise : il y a deux couronnes de sépales verts gris, autrement dit un calice double : une première couronne externe formée de six à neuf pièces courtes et triangulaires soudées entre elles (le calicule) et une seconde couronne interne de cinq sépales plus grands (jusqu’au double des précédents) et qui correspondent au « vrai » calice. Ainsi, le bouton floral se retrouve littéralement blindé d’autant que les sépales présentent une certaine épaisseur en plus des poils raides ; il s’agit là d’une protection renforcée pour un précieux trésor élaboré à grand coût d’énergie, de futures grosses fleurs.
Le calicule est une signature de nombreuses espèces de la tribu mais peut être très variable selon les genres, voire même manquer chez certains. On interprète l’origine de cette seconde protection comme étant le résultat de la réunion de bractées (feuille qui sous-tend une fleur) associées à une inflorescence qui s’est contractée en une seule fleur mais qui a conservé les bractées individuelles des fleurs disparues. Une telle évolution a du être sélectionnée du fait de son efficacité envers les prédateurs susceptibles d’attaquer les futures fleurs, ce qui augmente les chances de succès reproductif.
Le grand jeu
La corolle peut atteindre 5 à 10cm de diamètre, digne de celle des hibiscus. Elle se distingue au moment de l’éclosion par sa disposition « vrillée » ou tordue (préfloraison contortée) qui apporte une note esthétique supplémentaire le temps de son déploiement. On le retrouve chez les autres genres de la tribu notamment chez les hibiscus.
- Boutons floraux de rose trémière en train de s’ouvrir : la corolle apparaît enroulée en spirale
- De face, l’enroulement spiralé des pétales
- Cette préfloraison se retrouve chez de nombreuses autres espèces ; ici, la lavatère annuelle (Malva trimestris)
Les cinq pétales somptueux se chevauchent un peu par leurs bords mais sont quasiment libres à leur base sauf qu’ils se retrouvent indirectement soudés à la base d’une grande pièce centrale, la colonne staminale. De face, par transparence, on voit nettement les espaces vides qui les séparent à leur base comme des fenêtres qui servent peut être de guides aux insectes butineurs car c’est juste en dessous que se trouvent les nectaires, les petites poches qui secrètent le nectar recherché.
- Corolle de face : on devine au fond les « fenêtres » qui correspondent aux espaces entre les pétales non joints directement entre eux
- Qaund la fleur est fanée, la corolle tombe d’un bloc avec la colonne staminale : sur le « cadavre », on voit nettement les cinq fenêtres et la jonction des pétales avec la colonne staminale centrale qui coiffait l’ovaire.
Compte tenu de l’ancienneté de la culture de cette plante comme ornementale, les variétés culturales ne manquent pas. Elles se situent à deux niveaux : la couleur et le nombre de pétales. Pour les couleurs, toute la palette ou presque existe avec une dominante pour les teintes pastel dans les rouges et roses ; il y a aussi des variétés aux couleurs surprenantes comme le cultivar nigra, la rose trémière « noire », qui est en fait chocolat pourpré. Par ailleurs, on propose souvent des variétés dites doubles à allure de fleurs de pivoines à cause de pétales surnuméraires.
- Variété à fleurs doubles en forme de pivoine
- Variété à fleurs « noires »
La grande colonne
Même de loin, au centre de la fleur étalée, on distingue une étrange structure, inhabituelle (sauf dans cette tribu !) en forme de colonne dressée : la colonne staminale associée à sa base avec les pétales (voir ci-dessus). Cette colonne ou tube résulte de la croissance vers le haut d’un cercle initiateur des étamines dont les filaments se retrouvent unis (androcée monadelphe, i.e. en seul massif) sauf dans leur portion supérieure où ils se détachent entre eux. On a ainsi un bouquet serré à la base et qui s’étale en haut, avec au bout de chaque filament une anthère chargée de pollen. Chaque anthère en forme de rein se compose d’une seule loge et, à maturité, elle se fend au milieu alors qu’elle est tournée vers l’extérieur (extrorse). Ainsi, quand un insecte explore la corolle à sa base à la recherche du nectar caché entre les bases des pétales, il frotte tôt ou tard son dos sur les anthères nombreuses alors qu’il tourne au fond, allant de fenêtre en fenêtre (voir ci-dessus).
- En coupe, on voit l’ovaire basal (composé de plusieurs loges contiguës),la colonne trapue surmontée des bouquets d’étamines
- Quand un bourdon visite la fleur à la recherche du nectar, tout au fond, il se barbouille de pollen lors de ses déplacements au fond de la fleur
- Les filaments des étamines se détachent de la colonne dans la moitié supérieure
Quand les anthères ont libéré leur pollen et commencent à se flétrir, on voit apparaître au sommet de la colonne un second bouquet encerclé qui était resté caché jusqu’alors, les styles du pistil terminés chacun par un stigmate allongé chargé de capter les grains de pollen. Ils deviennent alors réceptifs et rapidement, ils se tordent vers l’extérieur jusqu’à toucher les anthères sur les côtés. La fleur de rose trémière est donc d’abord « mâle » (seules les étamines s’ouvrent) puis « femelle » avec la sortie des styles et stigmates du pistil : on parle de protandrie (proto : premier ; andro : étamines mâles). La séparation spatiale et temporelle des étamines et du pistil relève de l’hercogamie (hercos : barrière ; gamos : mariage) avec cependant une possibilité d’autofécondation en fin de floraison quand les styles se recourbent vers les anthères. Pourtant, ce recours final n’influence guère la production de graines puisque des fleurs émasculées (privées de leurs anthères) produisent autant de graines que des fleurs complètes alors qu’elles n’ont pas pu y recourir (1). Par ailleurs, 30% des fleurs suivies avaient réussi à produire des graines alors qu’elles n’avaient reçu aucune visite de pollinisateurs : l’autopollinisation est donc un recours intéressant en cas de manque de pollinisateurs (par mauvais temps prolongé en été par exemple).
- Les grains de pollen se collent sur les stigmates qui terminent les styles ; là, ils vont germer pour aller féconder les ovules situés tout en bas de la longue colonne !
- Colonne staminale en fin de floraison : les styles qui ont émergé au sommet se recourbent et touchent les anthères sur lesquelles il reste encore du pollen
- Colonne staminale d’un Hibiscus : la soudure est encore plus forte et les stigmates terminaux sont particulièrement développés.
Plats de résistance
Dans les jardins, les roses trémières constituent un pôle attractif majeur pour les abeilles et les bourdons essentiellement. Chaque fleur (2) produit presque 1mg de nectar ce qui est considérable, d’autant qu’il est relativement facile d’accès vu l’étalement de la fleur et sa taille. Au passage, ces insectes se « tartinent » de pollen qu’ils emportent ainsi à leur insu sans chercher à le récolter avec leurs pattes. Dans une étude (2), on a comparé les visites sur des fleurs « simples » et sur des fleurs doubles (voir ci-dessus) : pour les bourdons, durant les sept périodes de 5 minutes d’observations, il y a eu 30 visites pour 39 fleurs simples contre seulement 8 pour .. 68 fleurs doubles ! Ceci se comprend aisément car ces fleurs « touffues » sont peu accessibles. Ceci doit inciter à ne pas cultiver ces variétés doubles inintéressantes pour la faune locale même si elles peuvent présenter un certain charme.
- Bourdon qui visite une fleur de rose trémière ; il ne récolte pas le pollen mais recherche surtout le nectar au fond, entre les pétales
- Une abeille qui visite des fleurs de pommier : elle récolte le pollen (pelote sur les pattes arrière) ; ce pollen récolté est « perdu » pour la plante car il est aggloméré et sera transporté à la ruche.
A propos du pollen, une étude en laboratoire (3) a montré que les bourdons ne récoltent pas intentionnellement le pollen de ces fleurs pour le mettre en boulettes sur leurs pattes comme ils le font avec d’autres fleurs. La raison semble être le revêtement « épineux » (des spinules microscopiques) des grains de pollen pourtant très gros ; en « rasant » mécaniquement ce pollen, les chercheurs observent que les bourdons se mettent alors à le récolter, preuve que ce n’est pas lié à un goût désagréable. Les épines sont dépourvues de revêtement collant de sorte que les bourdons ne peuvent pas les agglomérer pour les récolter ! Ce caractère se retrouve chez de nombreuses malvacées et serait un dispositif de frein pour éviter que les butineurs ne récoltent trop de pollen qu’ils emmènent dans leur nid, pollen regroupé en boulettes et donc inopérant dans la pollinisation du point de vue de la fleur !
Plateau de fromage
Du pistil, nous n’avons vu jusque là que les styles et stigmates ; pour que la visite soit complète, il faut donc s’intéresser à l’ovaire du pistil qui contient les ovules, les futures graines une fois fécondés. Sur la fleur complète, l’ovaire reste invisible puisque complètement caché à la base de la colonne staminale qui l’enveloppe. Seule un coupe dans la fleur montre alors qu’il est constitué d’une série de loges disposées en cercle ou anneau ; dans chaque loge, il y a un seul ovule accroché sur l’angle interne de celle-ci. Pour voir l’ovaire sans effraction, il faut donc attendre la fanaison de la fleur et la chute de la corolle et encore se trouve t’il en grande partie dissimulé au creux de la coupe du double calice qui poursuit sa tâche protectrice.
- Quand la fleur a été fécondée, la corolle se replie et tombe d’une seule pièce emportant avec elle la coonne staminale flétrie à laquelle elle était attachée
A maturité, les loges se séparent les unes des autres tout en restant serrées et sont équivalentes à des akènes, des fruits secs à une seule graine soudée au fruit. On a donc un fruit multiple éclaté comme les parts de fromage sur un plateau ; d’où le surnom populaire de fromageon donné à ces fruits que l’on retrouve chez les mauves herbacées et qui faisaient la joie des enfants de la campagne (dont je fus !) comme objet d’émerveillement. Chaque loge durcie a la forme d’un croissant avec deux bords indurés saillants séparés par un sillon creux ; elles finissent par se détacher et tomber au sol, plus ou moins loin de la plante mère compte tenu de sa hauteur.
- Fruit vert caché par le calice resserré et hérissé de soies ; le calicule reste aussi mais tend à s’étaler en étoile par dessous.
- Schizocarpe mûr : les akènes placés en couronne autour du réceptacle central se séparent
- A maturité totale, le calice se désagrège et les akènes tombent
- Chaque akène est un disque et contient une seule graine.
Cette structure se retrouve chez une majorité de plantes de la tribu mais pas chez toutes comme les hibiscus ou les cotonniers et ketmies par exemple qui produisent des capsules. Le nombre de loges varie selon les genres porteurs ; chez la rose trémière, les schizocarpes sur les plantes de première année comptent environ 30 loges alors qu’à partir de la seconde année, ce nombre passe à 35-40. Si on multiplie par le nombre de fleurs, on obtient une production de l’ordre de 2000 fruits/graines par plante !
- Les mauves (ici, la mauve à petites fleurs) possèdent aussi des « fromageons » ou schizocarpes.
- chez les hibiscus (ici, la mauve en arbre), le fruit est une capsule qui s’ouvre en cinq loges.
La visite se termine ici. Il reste néanmoins encore beaucoup à découvrir à propos de notre belle passe-rose et notamment ses rapports avec un minuscule charançon gris au comportement surprenant. Ceci fera l’objet d’une autre histoire à boomer.
BIBLIOGRAPHIE
- Floral morphology and mating system of Alcea rosea. Li, Qun; Ruan, Cheng-Jiang; Teixeira da Silva, Jaime A.; Wang, Xue-Ying. Plant Ecology and Evolution, Volume 145, 2012, pp. 176-184(9)
- Garden Flowers: Insect Visits and the Floral Reward of Horticulturally-modified Variants. LIVIO COMBA, SARAH A. CORBET, A. BARRON, A. BIRD, S. COLLINGE, N. MIYAZAKI and M. POWELL. Annals of Botany 83: 73–86, 1999
- Just spines—mechanical defense of malvaceous pollen against collection by corbiculate bees. Klaus Lunau, Vanessa Piorek, Oliver Krohn, Ettore Pacini. Apidologie (2015) 46:144–149