Interactions indirectes : la face B des réseaux alimentaires
Les deux dernières décennies auront définitivement déboulonné les réseaux alimentaires de leur position de monopole absolu dans la vision grand public du fonctionnement des écosystèmes (mais aussi celle de nombreux scientifiques). Tout le monde connaît les chaînes alimentaires, au moins de nom et la majorité des gens conçoivent leur environnement comme un « champ de batailles » où les plus forts mangent les plus faibles (je caricature à souhait … quoique …). Le premier coup de boutoir contre cette vision centrée sur « le tout alimentaire direct» est venu avec la mise en évidence à l’échelle des communautés d’êtres vivants de réseaux incroyablement complexes d’interactions de type mutualistes à bénéfices réciproques comme celles liant plantes et pollinisateurs ou plantes et animaux qui dispersent les fruits et graines. Ces réseaux apportent une vision bien plus positive du fonctionnement du vivant et constituent une autre dimension de la biodiversité avec celle des espèces. Désormais, avec les interactions indirectes dont nous allons parler, c’est au sein même des réseaux alimentaires que l’on peut mettre en évidence des réseaux parallèles méconnus ou ignorés qui les enrichissent considérablement dans leur diversité. Alors, bienvenue dans ce nouveau monde des interactions indirectes avec deux exemples (1 et 2).
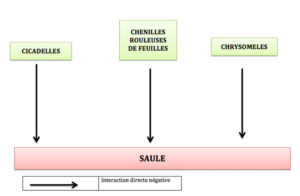
Pauvre réseau alimentaire

Manchon d’écume créé par une colonie de larves de cicadelles spumeuses au printemps sur un saule marsault en France (« crachat de coucou »)
Nous allons d’abord décrire un de ces réseaux pour mieux comprendre de quoi il ressort : ils est extrait d’études menées au Japon par le spécialiste de ce sujet, T. Ohgushi. Bien qu’ « exotique », il n’en est pas moins très proche de réseaux du même type existant sous nos climats tempérés. Rendons nous donc au Pays du Soleil Levant sur l’île d’Hokkaido le long de la rivière Ishikari où croissent des petits saules (Salix miyaebana). Ces derniers, comme tous les saules en général, hébergent une riche faune d’insectes herbivores représentée ici par trois guildes.
Une cicadelle spumeuse (Aphrophora pectoralis) prolifère sur les pousses terminales des saules où ses larves vivent en petites colonies au printemps ; elles piquent les tiges pour sucer la sève (comme des pucerons) ; elle rejettent la partie non assimilée sous forme d’une écume bulleuse qui s’accumule et forme autour d’elles un manchon spumeux protecteur connu sous le nom populaire de « crachat de coucou ».
- Larve de cicadelle dégagée de son manchon d’écume et attablée sur une tige d’arbre
- Cicadelle adulte (espèce inconnue) sous la loupe : on voit nettement le rostre piqueur avec lequel elle pompe la sève (à l’instar des punaises, des cigales et des pucerons)
- Manchon d’écume créé à partir de l’excédent de sève absorbée et rejeté à partir des glandes salivaires
Les feuilles servent d’abri et de nourriture à une légion de petites chenilles de papillons nocturnes qui roulent plusieurs feuilles en les liant par des fils de soie pour bâtir une sorte de fourreau en forme de cigare dans lequel elles se réfugient tout en rongeant les feuilles les plus internes. Au Japon, pas moins de 23 espèces différentes de « rouleuses » de feuilles exploitent ainsi le feuillage de ces saules.
- Feuille roulée par une chenille sur un peuplier tremble
- Feuilles repliées et collées ensemble par des fils de soie par une chenille sur un rosier cultivé
- La même feuille que ci-contre dépliée avec, à l’intérieur, la chrysalide issue de la chenille
Enfin, ce saule héberge des mangeurs de feuilles plus classiques sous la forme de petits scarabées, des chrysomèles, aussi bien au stade adulte que de larves ; une espèce domine tout particulièrement : la chrysomèle versicolore (Plagiodera versicolora) de 3 à 5mm de long et reconnaissable à son aspect brillant avec des reflets bleu ou vert métallique.
- Exemple de chrysomèle (espèce non identifiée) très proche de la chrysomèle versicolore
Bien, direz-vous, quoi de plus classique : on a l’a un réseau alimentaire ultra-banal et simpliste avec un suceur de sève sur les tiges et deux mangeurs de feuilles ! Pas si sûr : observons d’un peu plus près ce qui se passe au fil d’une année ….
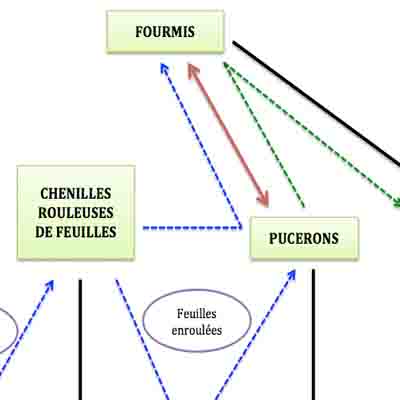
- Réseau alimentaire très simple … mais sans les interactions indirectes
L’effet cicadelle
En fin d’été, début d’automne, les femelles cicadelles pondent leurs œufs dans les pousses terminales toutes fraîches de l’été ; pour ce faire, elles piquent la pousse pour implanter leurs œufs ce qui provoque la nécrose de la pousse au-dessus du point de ponte. Mais, au printemps suivant, l’arbre réagit en stimulant la croissance des pousses en amont de ce point : ainsi se forment des pousses plus longues que la normale avec plus de feuilles. Ce simple changement va avoir un effet boule de neige sur la communauté des autres insectes herbivores. L’apparition de toutes ces feuilles nouvelles supplémentaires stimule en retour l’activité des chenilles rouleuses de feuilles qui trouvent là un matériau idéal pour faire leur abri et une source de nourriture tendre et fraîche : leur densité augmente sur les pousses « abimées » par les cicadelles. Une fois que les chenilles ont terminé leur croissance, elles se transforment en chrysalides d’où émergent ensuite des papillons. C’est alors qu’apparaît un quatrième larron : un puceron très spécialisé qui s’installe spécifiquement dans ces rouleaux désormais vides (Chaitophorus saliniger) ; jusqu’à 70% des rouleaux se trouvent ainsi occupés par des colonies de pucerons. Mais ce n’est pas fini !
Attirées par le miellat rejeté par ces pucerons (l’excédent de sève absorbée rejetée par l’anus), des fourmis viennent s’en nourrir et prennent soin des pucerons en les protégeant des prédateurs ; ici, trois espèces de fourmis viennent ainsi exploiter cette manne de miellat et investissent ainsi les tiges et les feuilles des saules.

Fourmi en train de « chatouiller » des pucerons pour les inciter à rejeter une goutte de miellat au bout de leur abdomen ; pour profiter de cette ressource, les fourmis protègent les pucerons des prédateurs et des compétiteurs qui pourraient les déranger ou les éliminer.
En fin de saison, le nombre de pucerons ne cesse d’augmenter (ils sont sous protection rapprochée !) ainsi que le nombre de fourmis. Celles-ci écartent tous les intrus, les prédateurs en première ligne (comme les coccinelles) mais aussi les mangeurs de feuilles indésirables qui risquent de manger les fourreaux où s’abritent les pucerons. Ainsi, les larves de chrysomèle versicolore, alors à leur pic d’abondance, se voient écartées ou tuées : leur taux quotidien de survie se trouve réduit de 60% et leur nombre diminue très fortement sur les pousses des cicadelles où s’étaient installées les chenilles dont les fourreaux ont attiré les pucerons qui ont ensuite attiré les fourmis !!!!
Interactions indirectes
Nous y voilà donc au cœur de ces fameuses interactions indirectes et, avec ce premier exemple, on en comprend tout de suite la signification. Au réseau alimentaire initial tr ès simple avec trois consommateurs et le saule, il faut donc en fait ajouter toute une série d’interactions indirectes liées à la réponse du saule à la ponte des cicadelles, réponse différée dans le temps (ponte en automne et effet observable au printemps suivant) et avec des effets en cascade eux-mêmes décalés dans le temps (arrivée des pucerons après le cycle des rouleuses de feuilles). Nous avons donc : une interaction positive entre cicadelles et chenilles rouleuses de feuilles via la croissance modifiée des pousses du saule ; une autre positive entre rouleuses de feuilles et puceron via les rouleaux de feuilles créées par les premières ; une autre positive entre rouleuses et fourmis via les pucerons qui produisent du miellat et une négative entre fourmis et larves de chrysomèles. Après la formation des rouleaux, trois interactions alimentaires indirectes se mettent en place : deux « négatives » entre saule et pucerons (ils prélèvent la sève de l’arbre) et entre fourmis et larves de chrysomèles et une positive entre pucerons et fourmis via le miellat.
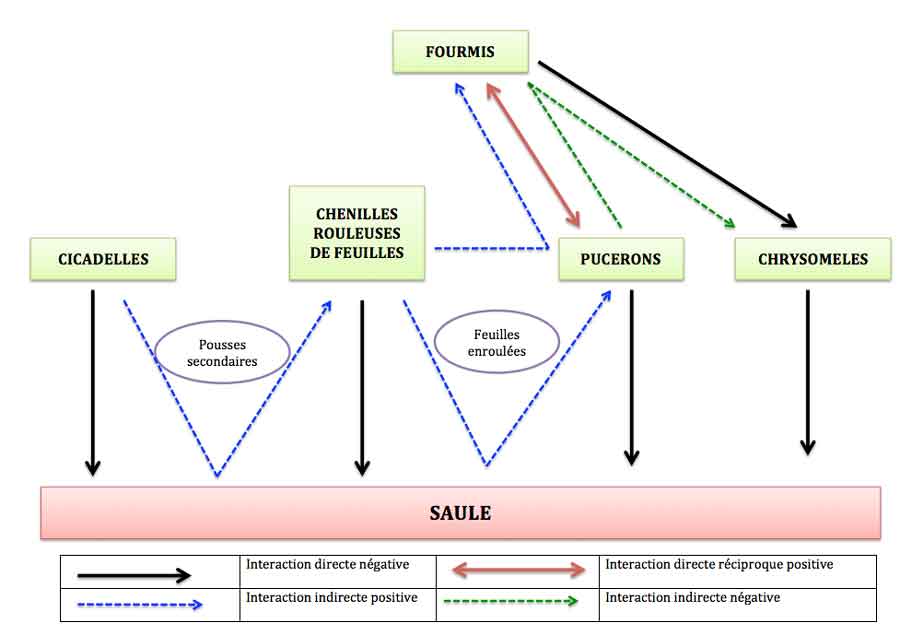
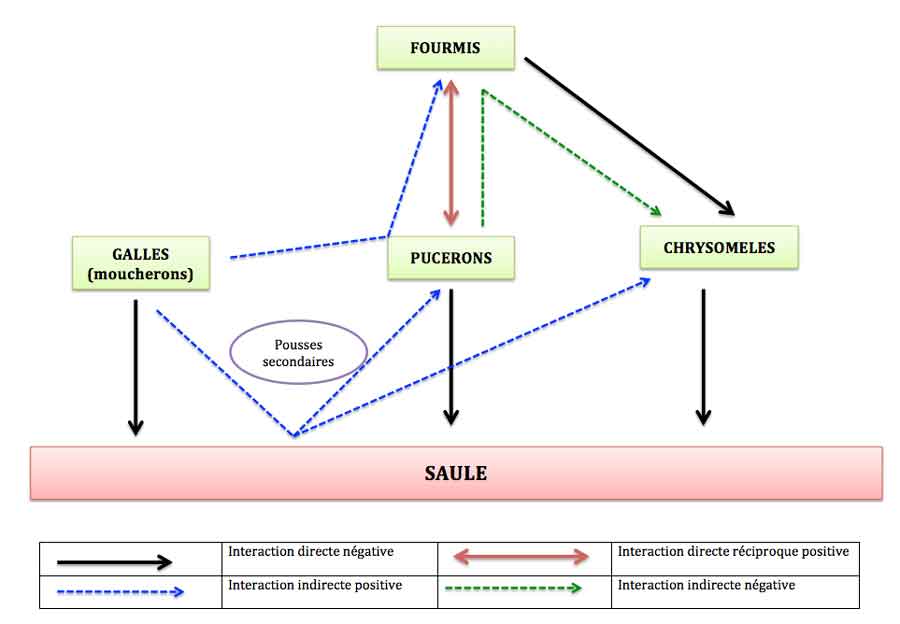
Réseau complet avec le interactions indirectes : une vision bien plus « riche » de la nature que le simple réseau alimentaire. Adapté d’après (1).
On aboutit ainsi à un réseau indirect nettement enrichi en interactions par rapport au réseau initial très simple dont de nombreuses interactions positives alors qu’initialement on n’a que du négatif (des insectes qui se nourrissent aux dépends du saule). Si ce n’est pas un changement de perspective, je mange mon chapeau de jardinier ! Un changement du même ordre que celui perçu quand on intègre les réseaux mutualistes de pollinisation, de dispersion (voir la chronique sur les réseaux mutualistes) !
L’effet galle

Galle en rosette (provoquée par une cécidomyie Rhabdophaga) installée à l’extrémité d’une pousse de saule blanc européen : noter la vigoureuse pousse latérale qui s’est développée en réponse à cette inhibition du bourgeon terminal.
Histoire de bien enfoncer le clou, voici une seconde histoire toujours au Japon (2). Nous sommes maintenant au centre du pays près de Shiga, au bord de la rivière Yasu où croissent plusieurs espèces de saules dont le saule à fruits velus (Salix eriocarpa). Sur les bourgeons terminaux des pousses de ce saule se développent vers la mi-juin des galles induites par les larves d’une mouche gallicole (Cécidomyie) du genre Rhabdophaga. Leur formation bloque ce bourgeon terminal ce qui provoque une vigoureuse réponse du saule : il développe des pousses latérales porteuses d’une seconde vague de feuillage tout frais au cœur de l’été.
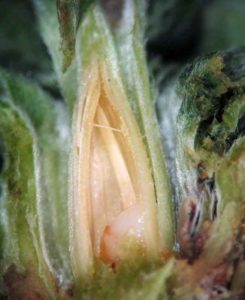
- Galle dite « rose de saule » provoquée par une mouche Cécidomyie du genre Rhabdophaga ; noter là encore la pousse latérale juste en-dessous de la galle
- Galle-rose en coupe : la présence de l’oeuf pondu puis de la larve induit la transformation profonde du bourgeon piqué dont les feuilles se transforment et délimitent une loge servant d’abri et de site de nourrissage.
Ces feuilles attirent alors des petits pucerons du saule (Aphis farinosa) : leur colonisation est quatre fois plus rapide sur les pousses porteuses de galles que sur les autres.
- Petit puceron du saule (Aphis farinosa) sur une feuille de saule cendré en France
Simultanément, deux espèces de chrysomèles, la chrysomèle versicolore (voir exemple précédent) et une chrysomèle noire et orange (Smaragdina semiaurantiaca) voient leur nombre augmenter fortement (de 3 à 10 fois plus sur les pousses porteuses de galles). Pucerons et chrysomèles sont en fait attirés vers ces pousses nouvelles à cause de leur qualité : ces nouvelles feuilles fraîches contiennent plus d’azote, plus d’eau et moins de fibres et sont donc nettement plus appétentes. De plus, la présence des pucerons entraîne là aussi l’arrivée de fourmis éleveuses qui, par contre, éliminent les larves de chrysomèles sur les pousses occupées par les pucerons. Le schéma ci-dessous résume ce réseau et permet de visualiser là encore l’enrichissement conséquent du réseau alimentaire initial assez pauvre.
Plasticité et ingénieurs
On peut déjà à partir de ces deux exemples assez simples (mais on en connaît d’ores et déjà des dizaines d’autres souvent bien plus complexe) dégager quelques points communs. Tout ce système repose en fait sur la capacité des saules à réagir à une attaque initiale (les cicadelles ou les galles) par une croissance secondaire accrue génératrice d’une nouvelle ressource plus intéressante et qui concentre de ce fait les insectes herbivores ultérieurs. Cette capacité repose sur ce qu’on appelle la plasticité phénotypique, la capacité d’un organisme au cours de sa vie individuelle, à exprimer à partir de son génome de nouveaux caractères temporairement en réaction à une perturbation (ici, une attaque d’herbivores).
L’autre aspect commun, c’est la capacité de certains insectes à modifier leur environnement via leurs interventions : les chenilles rouleuses de feuilles créent un nouvel environnement (abri) pour d’autres espèces ; on parle d’ingénieurs de l’écosystème. Ce peuvent être aussi par exemple des larves qui creusent des tiges créant des abris pour d’autres ou aussi les créateurs de galles, lesquelles deviennent à leur tout des abris pour une foule d’autres espèces.
- Deux exemples de « constructions » d’insectes ingénieurs capables de transformer indirectement les communautés locales. Les galles peuvent servir d’abri à une foule d’occupants secondaires et de parasites ; ici, les bédégars, ces grosses galles bien connues sur les églantiers
- Ces bédégars persistent en hiver et représentent des abris pour de nombreux petits arthropodes
- Un autre type de construction occupé secondairement : les mines creusées dans les feuilles par des larves d’insectes (ici sur une feuille de houx)
Ces espèces ingénieurs ont donc la capacité de transformer leur environnement et d’affecter la richesse en espèces et leur abondance dans les communautés dont ils font partie en donnant de nouveaux habitats pour des usagers secondaires. Nous avons déjà exposé un cas similaire avec l’exemple des réseaux de cavités en milieu forestier où les pics creuseurs de cavités occupent cette place-clé d’organismes ingénieurs (voir la chronique).
BIBLIOGRAPHIE
- Herbivore-induced indirect interaction webs on terrestrial plants: the importance of non-trophic, indirect, and facilitative interactions. Takayuki Ohgushi. Entomologia Experimentalis et Applicata 128: 217–229, 2008
- Gall initiation enhances the availability of food resources for herbivorous insects. M. NAKAMURA, Y. MIYAMOTO and T. OHGUSHI. Functional Ecology 2003 17, 851–857