Le gazé : l’elfe blanc des prés fleuris
Aporia crataegi
J’ai vraiment un faible pour le gazé, ce papillon pourtant d’apparence banale ! Mais passé le premier coup d’œil, on perçoit vite son élégance raffinée ou l’art de faire du très beau avec presque rien : que du blanc, mais quel blanc pur, un blanc neige souligné par un réseau de nervures noires. Chez les individus âgés, les ailes en perdant une partie de leur revêtement d’écailles deviennent presque hyalines d’où ce surnom de gazé au sens de gaze. Les anglo-saxons le nomment à juste titre le « blanc veiné de noir » (black-veined white). Et puis il y a sa façon de voler en alternant battements amples et planés qui lui donne cet air éthéré d’elfe léger comme l’air ! Pour moi, il évoque mon enfance dans le bocage berrichon où il abondait. Mais depuis quelques décennies, bien que toujours considéré comme assez commun car localement encore abondant, le gazé connaît un certain déclin : il pourrait bien devenir l’icône d’une campagne où alternent haies, bosquets et surtout prés fleuris, i.e. une campagne de moins en moins … ordinaire devant les assauts de l’agriculture intensive. Avec en plus le changement climatique en cours, comment les populations et la répartition de ce papillon autrefois banal vont-elles évoluer ?

Les gazés se regroupent souvent sur des fleurs pour passer la nuit et on les retrouve le matin, couverts de rosée, attendant les rayons du soleil pour se chauffer et entrer en activité.
Univoltin
Pour appréhender les enjeux de conservation de cette espèce, il faut évidemment bien connaître son cycle de vie. Les adultes apparaissent dès avril mais on les voit surtout en mai-juin jusqu’en juillet ; il n’y a qu’une génération par an : on parle donc d’espèce univoltine. Ils recherchent les prés fleuris pour y butiner les fleurs violettes, roses ou pourpres de référence, sources de nectar nutritif (voir ci-dessous) et , le soir, ils se rassemblent souvent en « dortoirs » en se fixant sur des tiges ou des fleurs, parfois en grappes de dizaines d’individus. Les matins de rosée, ils restent longtemps immobiles à se chauffer au soleil avant de s’envoler. Les mâles très actifs se bagarrent et pourchassent les femelles ce qui donne lieu parfois à des scènes de mêlées générales du plus bel effet. Les longs accouplements sont autant de belles occasions de photographier ces elfes blancs !
- Scènes de la vie ordinaire des gazés ….
- ….. 3 ou 4 mâles se disputent les faveurs d’une femelle
Les femelles pondent leurs œufs jaunes par paquets sous les feuilles d’arbres ou arbustes, tous de la famille des Rosacées avec en tête le prunellier et l’aubépine style mais aussi le cerisier de Sainte-Lucie et les arbres fruitiers cultivés. Les jeunes chenilles qui éclosent en début d’été vivent en groupes denses et tissent un réseau de fils de soie qui leur sert d’abri et de base pour aller ronger les feuilles alentour. Cette boule de soie deviendra leur « nid » dans lequel elles vont passer l’hiver. Tôt au printemps suivant, elles émergent et terminent leur développement, profitant des jeunes feuilles gorgées de nutriments des bourgeons en pleine croissance. Elles vont aller se chrysalider sur des herbes sèches ce qui donnera la génération d’adultes à partir d’avril.
- Chrysalide de gazé
Double exigence
Le cycle révèle, comme chez nombre d’autres papillons, une certaine dualité : le besoin de plantes à fleurs pour assurer la nourriture des adultes accaparés par la reproduction (parades, accouplements, production et ponte des œufs) et le besoin de plantes hôtes pour nourrir les chenilles et leur assurer un développement optimal. Une étude conduite en Slovénie (2) a étudié ces besoins. Les gazés exploitent neuf espèces de plantes à fleurs, celles les plus abondantes au moment de la période de vol avec deux espèces qui assurent 80% des besoins : une knautie et la vesce des crapauds ; ensuite viennent la sauge des prés et un trèfle local.
- Les Knauties et ….
- … la vesce des crapauds figurent dans le top 2 des plantes préférées des gazés
- Mais ils butinent aussi d’autres fleurs (comme cet oeillet des Chartreux) en général dans les tons pourpres, bleus ou violacés.
L’étude montre de grandes différences de densités selon les secteurs : tous les habitats ne se valent pas. Les densités les plus fortes s’observent là où des prés gérés de manière extensive (fauche annuelle ou pâturage extensif) côtoient des haies où se trouvent les plantes hôtes des chenilles, prunelliers et/ou aubépines. La densité de ces arbustes ne détermine pas l’abondance des gazés adultes car prunelliers et aubépines abondent partout mais c’est leur position par rapport aux sources de nectar, les prés fleuris, qui importe. Les gazés ont besoin d’un paysage mosaïque comme celui entretenu depuis des siècles par une agriculture traditionnelle et sans pesticides.
- Trois exemples de paysages mosaïques propices au gazé photographiés en Auvergne : des haies et des bosquets
- … des prés secs fleuris ….
- … des lisières buissonnantes
Or, l’exode rural conduit souvent à l’abandon de ces pratiques : soit les prés sont mis en culture ou exploités de manière plus intensive et artificialisés, soit ils sont abandonnés et colonisés par des arbustes qui ferment le milieu. Il ne suffira donc pas de préserver des zones suffisamment grandes pour englober ces deux types d’habitats mais il faudra aussi s’assurer que l’agencement spatial des haies ou lisières avec arbustes et des prés fleuris permet la survie des populations de gazés.
Mobilité
Dans l’étude slovène, on a cherché à savoir comment les gazés résolvaient cette dualité en marquant plus de 1000 individus et en cherchant à les recapturer au bout d’un certain temps. L’opération de capture pour le marquage montre d’abord une surreprésentation des mâles (2 pour 1) ce qui correspond peut être à leur comportement différent : ils passent plus de temps à patrouiller et circuler à la recherche des femelles alors que celles ci bougent moins. D’ailleurs, elles ont une longévité moyenne légèrement supérieure à celles des mâles (7,5 jours versus 7,2).De plus, les femelles émergent un peu après les mâles et le pic de densité des femelles est décalé d’environ 8 jours par rapport à celui des mâles.
- La reproduction accapare beaucoup les gazés : leur durée de vie est courte
- Même lors des longs accouplements, le tandem mâle/femelle peut se déplacer en vol !
La différence principale porte sur la capacité à se déplacer, à se disperser dans l’espace : 31% des mâles marqués sont recapturés contre seulement 9% des femelles et surtout les distances parcourues entre le lieu de capture et celui de recapture divergent nettement. Les mobilités moyenne et maximale sont de 640 et 3493m pour les mâles contre 604 et 3166m pour les femelles. En dépit de ces différences liées aux comportements, il ressort globalement l’image d’une espèce hautement mobile pouvant se déplacer sur des distances de plus de 3 km ce qui est considérable. Ainsi, via cette capacité de dispersion forte les gazés ont pu depuis des siècles maintenir des populations fragmentées selon la structure paysagère tout en entretenant des échanges entre ces noyaux (métapopulations). Les gazés ont donc un certain potentiel pour se maintenir mais si la matrice paysagère devient trop distendue, ils ne pourront plus suivre la tendance et les populations deviendront de plus en plus isolées avec des risques d’extinction locale définitive. Et pour pouvoir passer d’un milieu à un autre s’ils deviennent distants, il faut des relais avec des sources de nectar pour se ravitailler donc des prés fleuris.
- Les deux plantes hôtes des chenilles : les prunelliers …
- … et les aubépines. D’où l’importance des réseaux de haies vives dans le paysage.
Migration
Dans la partie méditerranéenne de son aire de répartition, le gazé tend à se confiner en altitude, dans une ambiance climatique plus fraîche, comme dans le centre de l’Espagne où une étude a été menée (3). Il se trouve donc là particulièrement exposé au changement climatique en cours. Dans les années 1967-73, le gazé occupait dans la sierra de Guadarrama la tranche d’altitude comprise entre 640 et 1800m. Le bilan effectué en 2006 montre qu’il a complètement disparu entre 640 et 900m d’altitude alors que ses plantes-hôtes (là aussi le prunellier et l’aubépine) y sont toujours aussi présentes : ce retrait résulte d’extinctions locales des populations pourtant florissantes jusque là. Par contre, fait intéressant, sa limite supérieure n’a pas changé : il reste en dessous de 1800m alors qu’on aurait pu penser qu’il allait glisser vers des altitudes supérieures. La raison en est assez évidente : les plantes hôtes se raréfient au dessus de 1400m et restent toujours absentes au dessus de 1800m.
Pour comprendre ce processus, les chercheurs espagnols ont effectué des transplantations de pontes ou de groupes de jeunes chenilles dans la zone basse désertée : sur 14 essais, 9 ont complètement échoué sans éclore ou réussir à former un nid communautaire. Les œufs restent intacts sur les feuilles mais n’éclosent pas ce qui écarte l’hypothèse d’une recrudescence du parasitisme dans cette zone suite au réchauffement. Ce dernier agit directement sur le devenir des pontes et le gazé se trouve donc pris en étau sans pouvoir monter en altitude. Cependant, il semble s’adapter à la nouvelle situation puisqu’en altitude (au-dessus de 1400m), les femelles pondent de préférence sur les feuilles ce qui expose les œufs à la chaleur et facilite leur développement ; plus bas, elles pondent sous les feuilles, à l’abri des ardeurs du soleil !
La seule échappatoire qui pourrait rester au gazé serait un glissement vers d’autres plantes hôtes car les chenilles peuvent en fait se nourrir sur diverses rosacées. Or, récemment, des pontes ont été observées sur des églantiers (membres de la famille) et ces derniers montent au-dessus de 1800m ; mais des expériences d’élevage montrent que les chenilles ne se développent pas ? A suivre !
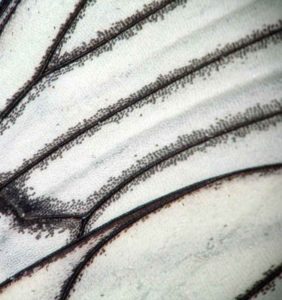
- De loin, on a l’impression que les nervures des ailes sont particulièrement larges
- Des rangées d’écailles grises ourlent les nervures et leur donnent cette apparence épaissie
- De plus près, on découvre le délicat motif d’écailles
Réintroduction
Au début du 19ème siècle, le gazé était répandu en Grande-Bretagne jusqu’en Ecosse tout en montrant de fortes fluctuations d’abondance. Dès le milieu du 19ème, le déclin avait commencé et s’est accentué au début du 20ème siècle où il ne subsistait plus que dans le Kent. Là, il s’y est éteint en 1922. Depuis, plusieurs tentatives de réintroduction à partir de populations continentales ont échoué. Une étude récente (4) de modélisation a cherché à savoir si, avec le réchauffement global, le gazé ne pourrait pas être maintenant réintroduit avec plus de succès. Avec trois scénarios climatiques jusque dans les années 2050, les chercheurs montrent que les conditions climatiques sur le sud et l’est de la Grande-Bretagne resteront favorables au gazé, avec notamment une diminution favorable des précipitations estivales. Restent à étudier les conditions de milieu actuelles pour choisir les zones potentiellement les plus aptes à recevoir ces nouvelles tentatives de réintroduction.
On voit donc que l’avenir de ce papillon emblématique d’un environnement agricole piloté par les activités humaines reste bien incertain mais qu’il a quelques atouts pour surmonter ces épreuves : sa grande mobilité et, peut-être, sa capacité à adopter une gamme plus étendue de plantes hôtes pour ses chenilles. En tout cas, en France, il serait temps d’inscrire cette espèce, considérée encore comme non menacée, sur la liste des « à surveiller » quand on connaît l’évolution des pratiques agricoles globalement !
BIBLIOGRAPHIE
- La vie des Papillons. T. Lafranchis et al. Ed. Diatheo. 2015
- Movement, demography and behaviour of a highly mobile species: A case study of the black-veined white, Aporia crataegi (Lepidoptera: Pieridae). JURE JUGOVIC , MITJA ČRNE and MARTINA LUŽNIK. Eur. J. Entomol. 114: 113–122, 2017
- Combined effects of climate and biotic interactions on the elevational range of a phytophagous insect. Richard M. Merrill et al. Journal of Animal Ecology 2008, 77, 145–155 Ltd
- Climate change and translocations: The potential to re-establish two regionally-extinct butterfly species in Britain. Carroll, M.J., et al. Biol. Conserv. (2009),