L’évolution d’un escargot sous la loupe des sciences participatives
Cepaea nemoralis
L’escargot des bois est une espèce très commune et célébrissime dans le monde scientifique depuis les années 1940 dans les domaines de l’hérédité, de l’évolution et de l’écologie. Il cumule plusieurs caractères originaux qui expliquent cet engouement de la communauté scientifique envers ce banal gastéropode. Depuis les années 2000, le monde des sciences participatives (voir la chronique sur ce sujet) s’en emparé avec deux projets, l’un à l’échelle européenne (Megalab) entre 2000 et 2009 avec près de 500 000 escargots recensés sur un site web dédié et l’autre à l’échelle des Pays-Bas (SnailSnap) via une application Smartphone avec 8000 escargots photographiés et répertoriés. Cette dernière enquête apporte un éclairage intéressant sur l’évolution, observée presque en direct, des populations urbaines de cette espèce par rapport aux populations non urbaines.
Espèce modèle
Pourquoi les scientifiques s’intéressent-ils tant et depuis si longtemps à cette espèce en particulier ? en fait, deux espèces très proches, presque jumelles, ont fait l’objet d’études scientifiques : l’escargot des jardins (Cepaea hortensis) et l’escargot des bois (C. nemoralis). Toutes les deux partagent un caractère déroutant pour le naturaliste : le polymorphisme coloré ; ceci signifie qu’il existe au sein de chacune des deux espèces une gamme de variations très étendue à la fois dans la couleur de fond de la coquille et dans ses ornementations éventuelles sous forme de bandes colorées. L’escargot des bois se distingue de son « jumeau » par un critère facile à observer : l’ouverture de la coquille (par où l’animal sort son corps) possède une bande noire qui la surligne, absente chez l’escargot des jardins. En pratique, pour les études de sciences participatives, on a retenu seulement ce dernier pour s’assurer d’une identification correcte via ce critère. Près de 200 formes colorées ou morphes sont connues sur l’ensemble de l’Europe. La couleur de fond varie du jaune au rose en allant jusqu’au brun, avec pour chaque couleur des nuances plus ou moins foncées. Sur cette variation de fond, se surimpose la variation des bandes colorées sombres en spirale au nombre variant de 0 à 5 ! Ces variations ont une base génétique héritable bien connue (voir paragraphe suivant).
Mais cette espèce présente d’autres caractères avantageux pour une étude de type participatif impliquant donc le grand public plus ou moins novice. Il s’agit d’une espèce très commune, sans doute la plus commune de tous les escargots terrestres dans nos régions tempérées, et répandu dans une large gamme d’habitats très variés : dunes côtières, bois, haies, talus, chemins, friches, bords de routes et habitats gérés par l’homme (jardins, parcs urbains, terrains vagues, cimetières, espaces verts, …). En altitude, il monte jusqu’à 2100M ! Ses couleurs vives, sa taille moyenne, son habitude d’estiver (vie ralentie par temps sec) en se collant sur des supports bien en vue le rendent facile à trouver et à photographier.
Couleurs influentes
Au delà de cette étonnante variation, la coloration des coquilles présente un autre intérêt majeur pour les scientifiques : elle interfère fortement avec la vie et le succès reproductif de cette espèce et donc son évolution via plusieurs fonctions. La couleur de fond et les bandes sombres interviennent dans la thermorégulation, la capacité pour ces animaux « à sang froid » de réguler leur température interne soit pour se réchauffer, soit pour lutter contre l’excès de chaleur selon les milieux de vie. Comme les différentes couleurs absorbent différemment les rayons solaires, leur impact sur le comportement et la physiologie de cet escargot va être déterminant, notamment dans le contexte actuel de profond changement climatique. Les colorations claires absorbent plus la chaleur que les colorations sombres ; quant aux bandes sombres, elles interfèrent d’une manière très subtile (voir la suite). Mais la couleur et les motifs colorés jouent un autre rôle décisif dans la capacité à échapper à la vue des prédateurs en offrant plus ou moins de mimétisme avec l’environnement proche. Parmi les nombreux prédateurs des escargots, des proies faciles et peu mobiles a priori, figure la grive musicienne qui recherche activement les escargots des bois de taille moyenne qui correspond à son bec. Elle les récolte et casse leur coquille en les frappant sur des pierres plates qui lui servent d’enclumes et où s’accumulent des dizaines de coquilles ; ainsi, on peut savoir quels morphes colorés la grive capture préférentiellement. Dans ce contexte de pression de sélection de la prédation, les bandes sombres peuvent ainsi apporter un certain camouflage selon l’environnement. Enfin, la mélanine, ce pigment noir qui colore les bandes sombres, rendrait la coquille plus dure, un effet connu par ailleurs sur les barges des plumes des oiseaux par exemple.

Grive musicienne (Photo J Lombardy) 
Coquilles cassées sur une enclume de grive 
La coquille est brisée et non pas rongée en la frappant sur un caillou
Contrôle génétique
L’élément déterminant pour le choix de l’escargot des bois comme espèce modèle reste le déterminisme génétique de ces caractères liés à la coloration, un aspect étudié et bien connu depuis longtemps. La couleur de fond comme les motifs de bandes sont des caractères héritables contrôlés génétiquement d’une manière relativement simple, ce qui rend renforce l’intérêt de cette espèce pour les scientifiques. Brièvement, avec le jargon propre à la génétique, voyons les contours de ce contrôle : si vous n’êtes pas familier de ce langage, vous pouvez passer au paragraphe suivant sans que cela ne gène votre compréhension de l’histoire. .
La couleur est contrôlée par un seul gène (locus) que l’on nomme C avec trois variantes (allèles) principales : brun (Cb), rose (Cr) et jaune (Cj). La couleur brune est dominante par rapport au rose qui lui-même est dominant par rapport au jaune. Les individus jaunes sont des homozygotes double récessif CjCj pour ce gène.
La présence de bandes est, quant à elle, contrôlée par plusieurs gènes. L’un d’eux nommé B possède plusieurs variantes et se trouve lié au gène de la couleur C ; ainsi, les individus jaunes (voir ci-dessus) n’ont pas de bandes. Il en existe un autre nommé U qui par contre est indépendant de B et C : son allèle dominant supprime les bandes n° 1, 2, 4 et 5 ne laissant qu’une seule bande au milieu de la coquille, un variant facile à repérer sur le terrain. A l’inverse, les individus qui possèdent l’allèle récessif u en double ont 5 bandes.
SnailSnap
Une équipe de chercheurs néerlandais a donc initié une étude nationale sur l’escargot des bois via une plate forme de sciences participatives dédiée au recensement général de la biodiversité aux Pays-Bas. Ils ont donc mis en place une application Smartphone SnailSnap qui permettait aux participants de saisir leurs observations d’escargots géolocalisées et de joindre à chaque fois une photo de l’animal et de sa coquille. Grâce au réseau d’observateurs déjà impliqués, des citoyens pas forcément naturalistes aguerris mais simplement intéressés par leur environnement, sur la plate-forme nationale (un peu l’équivalent de Faune France ), ils ont ainsi pu collecter près de 8000 données différentes d’escargots des bois réparties sur l’ensemble du pays.
Ce projet avait été mis en place avec un objectif bien précis : évaluer l’impact du microclimat urbain sur l’évolution de la coloration des coquilles de ces escargots. En effet, du point de vue climatique, le milieu urbain se distingue par ce qu’on appelle « l’îlot de chaleur urbain » (ICU pour la suite). Ce concept recouvre l’élévation des températures de plusieurs degrés (surtout les maximales diurnes et nocturnes) en milieu urbain par rapport aux zones non urbanisées situées à la périphérie des villes : on peut l’interpréter comme un sorte de dôme thermique qui chapote la ville, une sorte de couvercle qui la maintient sous serre lié aux dégagements de chaleur, à la réflexion de la lumière et de la chaleur par les surfaces bâties, au dôme de pollution, … C’est ce qui explique notamment le moindre nombre de jours de gel, le dérèglement des périodes de floraison et bien d’autres phénomènes liés au climat local.
L’idée initiale des chercheurs était donc que cet ICU, partagé par une majorité de grandes villes, devait exercer une forte pression sélective sur un animal à sang froid comme l’escargot des bois et notamment sur la couleur de sa coquille liée à sa thermorégulation (voir le premier paragraphe). Ils ont donc demandé aux observateurs de prospecter aussi bien au cœur des villes qu’en périphérie et dans environnements non urbanisés tels que forêts, terres agricoles, dunes côtières, … afin de disposer d’un élément de comparaison. Les caractéristiques de l’escargot des bois évoquées ci-dessus en faisaient une espèce idéale pour un tel projet vu qu’il fréquente aussi bien les campagnes que les zones urbanisées. Quatre grands types d’habitats ont ainsi été définis, la géolocalisation permettant a posteriori de les caractériser : zones cultivées ; espaces naturels dont forêts ; zones urbaines vertes (parcs, espaces verts) ; zones urbaines grises (zones industrielles, zones commerciales ou résidentielles).
Jaunissement
Venons en donc aux résultats de cette grande enquête. Par rapport à la couleur de fond, il apparaît de manière significative qu’il y a proportionnellement plus d’escargots des jardins à coquille jaune en milieu urbain que dans les milieux non urbains ; le pourcentage des bruns ne varie pas entre ces deux grands d’environnements ; corrélativement, il y a moins d’escargots à coquille rose en milieu urbain. En incluant les données climatiques (sur la base des données géolocalisées), on démontre que cette tendance est clairement liée à l’ilot de chaleur urbain (ICU) : les conditions climatiques urbaines exercent donc une pression de sélection favorable aux jaunes et défavorable aux roses. L’effet se manifeste aussi bien dans les zones urbaines « vertes » que « grises » (voir le sens de ces mots ci-dessus), preuve supplémentaire qu’il dépend plus de la température ambiante que de caractères liés à la structure ou à la biodiversité des différents milieux urbains. Cependant, il semble y avoir une limite à cette tendance : quand on s’approche des maximas de l’ICU, la proportion de jaunes cesse de croître.
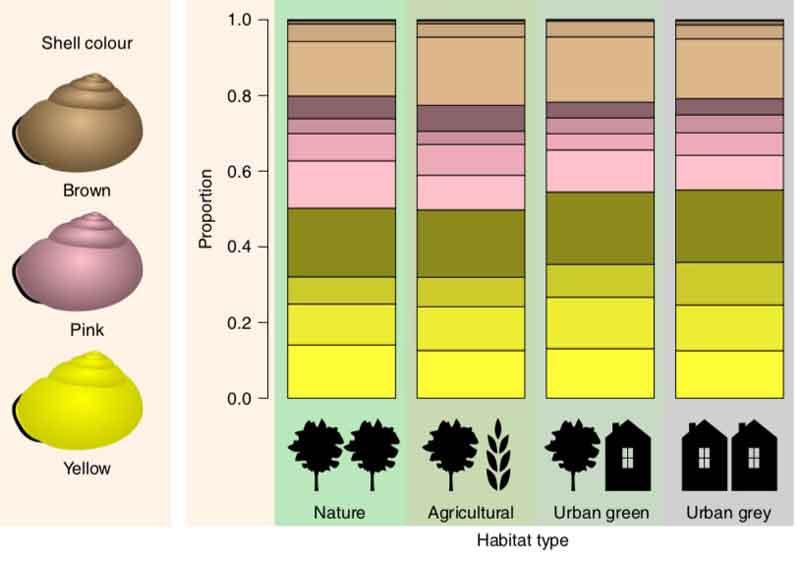
Pour expliquer cette évolution révélée par l’enquête, il faut revenir vers le comportement thermorégulateur de ces escargots. On sait à partir d’expérimentations que les escargots jaunes survivent mieux sous des régimes de températures élevées sans doute à cause d’une plus grande proportion des radiations solaires reçues par la coquille réfléchies par celle-ci (albedo) ; on sait aussi que les brun set les roses voient leurs températures internes s’élever plus dans de telles conditions. L’ICU imposerait donc une pression sélective forte en faveur du gène récessif jaune quant à la couleur de fond des coquilles.
Bandes colorées
Les résultats à propos de l’ornementation des coquilles par des bandes sombres, absentes ou présentes en plus ou moins grand nombre, s’avèrent plus complexes. Ces bandes colorées ne concernent que les jaunes ou les roses puisque les bruns n’en portent qu’exceptionnellement. Pour les jaunes, la probabilité d’être sans bandes ou avec 5 bandes diminue quand la température augmente tandis que corrélativement la proportion des unibandes et à 3 bandes augmente. Pour les roses, la proportion d’individus à 3 bandes augmente dans les ICU. En analysant plus finement, on se rend compte que l’effet de la température sur le nombre de bandes dépend du nombre de jours secs, un facteur clé pour les escargots qui restent alors inactifs (en estivation). Or, aussi bien pour les jaunes et encore plus pour les roses, une augmentation du nombre de jours secs réduit la probabilité d’une coquille avec bandes versus une coquille sans bandes. Si le nombre de jours secs n’influe pas significativement sur la couleur rose ou jaune des coquilles, il agit sur les roses : plus il y a de jours secs, plus il y a d’escargots roses sans bandes et plus ils sont grands en taille.
Physiquement, la présence de bandes sombres réduit l’albedo de la coquille qui absorbe plus de radiations solaires ce qui devrait donc faire monter la température interne dans les ICU : logiquement, le caractère « présence de bandes » devrait donc être contre-sélectionné puisque préjudiciable à la survie. Or, ceci ne vaut que pour le type à 5 bandes. Les deux autres types (une seule ou trois bandes), au contraire, voient donc leur fréquence augmenter en milieu urbain dans les ICU ! D’autres études sur cette espèce démontre le même résultat face au réchauffement climatique global à grande échelle. Comment interpréter ces résultats un peu contradictoires en apparence ?
Autres causes
On sait que la présence de bandes sombres, faites d’un piment, la mélanine, qui durcit les coquilles, les rend plus résistantes aux tentatives d’attaques de prédateurs « moyennement » armés pour les briser comme les oiseaux : donc la prédation pourrait être, pour ce caractère, un facteur sélectif. D’autre part, dans certains milieux de vie, les bandes peuvent apporter du camouflage et là encore permettre d’échapper en partie à la prédation. Il faudrait donc être capable de tester si, en milieu urbain, la pression sélective de la prédation diffère de celle dans les milieux non urbains : guilde de prédateurs différente, effectifs des prédateurs clés différents, couleurs de fonds des milieux différentes ?
Mais il n’est pas exclu non plus que les bandes sombres interfèrent d’une manière encore non comprise avec la thermorégulation. Le cas étudié de la caragouille rosée (Theba pisana), un petit escargot très commun dans les milieux chauds et secs comme les dunes, avec lui aussi de fortes variations dans les ornementations de sa coquille très claire, apporte quelques indices en ce sens. On a démontré que chez les individus de cette espèce porteurs de bandes sombres sur le fond très clair de la coquille, cela augmentait la capacité à refroidir leur corps après une exposition à la chaleur : cet effet contre-intuitif s’expliquerait par la création à la surface de la coquille d’un flux d’air différentiel entre zones claires et sombres qui alternent et par une plus forte dissipation de chaleur via les bandes sombres ! Si on transpose ces résultats aux escargots des bois jaunes, la présence de bandes sombres (1 ou 3) se combinerait avec le plus grand albedo procuré par la couleur jaune et sélectionnerait les escargots jaunes qui ont la partie supérieure exposée à la lumière sans bandes (et donc plus réfléchissante) tout en ayant des bandes sur le bas de la coquille ce qui améliorerait le refroidissement. Et à tout cela, il faudrait, peut-être donc, ajouter l’effet camouflage plus subtil selon la structure de la végétation des milieux.
Au final, cette belle étude nous apporte deux satisfactions : celle de démontrer, s’il en était encore besoin, que le processus d’évolution des populations est permanent, se déroule sous nos yeux sans que nous en ayons conscience et qu’il transforme les populations selon les modifications des milieux. D’autre part, cette étude illustre la puissance des sciences participatives à apporter de nouvelles informations scientifiques à condition de bien choisir les espèces cibles et les protocoles. J’y vois enfin une superbe occasion d’ouvrir le regard de tout un chacun sur tous ces êtres vivants, « banals » (tout comme nous, êtres humains !) qui vivent autour de nous, avec nous et que nous ignorons souvent superbement quand nous ne les détruisons pas sans même nous en rendre compte. Une manière de se reconnecter aux autres êtres vivants … via un smartphone : belle revanche et preuve que internet peut être un outil très positif pour l’environnement !
Bibliographie
Snail shell colour evolution in urban heat islands detected via citizen science. Niels A.G. Kerstes, Thijmen Breeschoten, Vincent J. Kalkman & Menno Schilthuizen. COMMUNICATIONS BIOLOGY | (2019)2:264
Citizen Science Reveals Unexpected Continental-Scale Evolutionary Change in a Model Organism.Silvertown J, Cook L, Cameron R, Dodd M, McConway K, et al. (2011) PLoS ONE 6(4): e18927.
Site Megalab (étude européenne) : http://www.evolutionmegalab.org/fr




















