Bignone : fleur dédiée aux colibris … mais pas que !
Campsis radicans
Nombre de plantes exotiques sont cultivées depuis si longtemps et devenues si populaires par leur beauté et/ou leur rusticité ou facilité de culture que le grand public tend à en faire des plantes indigènes. Les bignones font partie de ce cercle et occupent les premiers rangs dans les choix des plantes grimpantes aux côtés des glycines ou des clématites exotiques : l’espèce la plus cultivée nous vient des Etats-Unis sous les appellations de bignone de Virginie ou de jasmin trompette. Pour autant, si l’on connaît bien le nom et le mode de culture de cette liane (les sites et magazines de jardinage restent intarissables là-dessus et n’en débordent pas), on méconnaît presque complètement ses origines et milieux de vie, sa biologie, et ses particularités anatomiques, physiologiques ou écologiques. Au plus nous distille t’on quelques informations sur son histoire. Ainsi, l’étrange nom de bignone dérive du latin Bignonia (repris pour désigner la famille des Bignoniacées dont elle fait partie), nom créé pour désigner initialement ces plantes et dérivé du nom d’un un prédicateur du roi Louis XIV, l’abbé J. P. Bignon, (1662-1743) à qui on a dédié cette plante même s’il n’est pour rien dans sa découverte. Plus tard, elle fut placée dans le genre Campsis, un mot dérivé du grec signifiant courbure (des tiges ou des fruits) ; quant à l’épithète radicans, il renvoie aux racines-crampons portées par les tiges grimpantes.
- Crampons sur les tiges comparables à ceux du lierre
- Bignone sur une façade
- La bignone à vrilles appartient au genre Bignonia et est proche parente des Campsis
Pour pallier à l’absence d’intérêt pour la plante elle-même, autrement que pour ses rapports avec l’homme, nous allons ici nous attarder longuement sur ses fleurs et leur mode de reproduction qui ont fait l’objet de nombreuses études et s’avère riche en anecdotes surprenantes.
Trompette
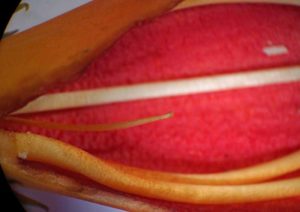
L’appellation de jasmin (voir introduction) est complètement erronée à part le partage d’un port grimpant et de feuilles composées : les jasmins sont des parents des lilas et des troènes dans la famille des Oléacées ; par contre, le qualificatif de trompette convient bien pour ses fleurs. Groupées par paquets d’une douzaine au bout des pousses de l’année, elles se démarquent par leur couleur rouge vif (orange à jaune dans certains cultivars) et la forme en gros tube allongé (6 à 8cm de long) de la corolle ; celle-ci se termine par une embouchure de cinq lobes triangulaires étalés : de face, on remarque une certaine dissymétrie haut/bas (fleur zygomorphe) et sa large ouverture qui permet de voir presque jusqu’au fond. Toujours de face, on remarque au plafond, en arrière de l’entrée, trois éléments groupés : pour y voir plus clair, il faut accepter de déchirer délicatement une corolle.
- Fleur ouverte du côté de la lèvre inférieure : les deux paires d’étamines et le stigmate bilobé qui dépasse en avant s’appuient sur la lèvre supérieure
- Fleur ouverte côté lèvre supérieure : le long style issu de l’ovaire (non visible ici) se termine par le stigmate
- Les deux paires d’étamines décalées et le stigmate bilobé qui les dépasse d’une courte tête
- Vers la base, ce petit filet correspond à la cinquième étamine réduite à l’état stérile de staminode
Au milieu dépasse le stigmate constitué de deux lobes aplatis (dont nous reparlerons longuement) et porté par un long style qui monte depuis le fond de la fleur, au sommet de l’ovaire allongé, porté lui-même sur un court pédicelle. De chaque coté, un peu en arrière, apparaît une paire d’étamines longues dont les anthères à deux loges se trouvent réunies, encadrant le style et laissant passer en avant le stigmate. Si on s’enfonce dans la fleur, tel un insecte butineur, on rencontre plus bas, une seconde paire d’étamines elles aussi couplées par leur anthères ; la courbure des filaments fixés vers la base de la corolle permet leur rapprochement. On croise aussi une sorte de filament isolé : c’est la cinquième étamine réduite à l’état de staminode stérile. On atteint enfin l’ovaire un peu anguleux et, tout au fond, on tombe sur un gros disque jaunâtre charnu, le nectaire, l’organe de fabrication d’un abondant nectar.
- Corolle ouverte : le disque charnu orange est le nectaire basal ; au-dessus on truie l’ovaire ventru d’où part le long style ….
- … terminé par un stigmate bilobé foliacé
A l’extérieur, outre le pédicelle vert (avec deux bractées minuscules) qui porte chaque fleur, on découvre le calice, remarquablement charnu et coloré d’orangé, avec ses cinq lobes pointus. Avant l’éclosion, le calice est bien plus visible et quand la corolle émerge, ses cinq lobes terminaux sont repliés, donnant l’apparence d’une bouche fermée.
Chatouilleuse

Fleur de droite : le stigmate est largement ouvert ; fleur de gauche : le stigmate est en partie replié
Le stigmate de la fleur retient l’attention autant par sa position en avant, dès l’entrée du tube floral mais aussi par sa forme originale. Habituellement, le stigmate ressemble à une boule ou une massue allongée mais ici il se déploie en deux lobes aplatis larges de près de 3mm dont la surface interne porte un revêtement de papilles chargées de collecter les grains de pollen. Ces lobes ont une particularité étonnante : si on les touche (ou plutôt si un visiteur ailé le touche) ou si du pollen est déposé dessus, ils se resserrent l’un contre l’autre. Le stigmate se ferme et devient inactif puisque les deux surfaces réceptrices sont alors cachées. Cette fermeture prend environ une quarantaine de secondes. Si le déclencheur a été un contact physique avec le corps d’un insecte ou d’un colibri (voir ci-dessous), en général le stigmate va se rouvrir peu après et se remettre en position de recevoir du pollen. Par contre, si à cette occasion une quantité suffisante de grains de pollen a été déposée en quantité suffisante (la charge minimale serait autour de 350 grains), alors la fermeture devient définitive. Il s’agit donc clairement d’un mécanisme permettant de contrôler la pollinisation.
- Stigmate déployé (« ouvert ») en avant des anthères
- Stigmate refermé en fin de floraison (les anthères sont ouvertes)
- Lobes du stigmate côté intérieur : c’est là que le pollen est capturé ; il ne peut donc se déposer que si ces lobes sont ouverts
- Gros plan sur un lobe avec les papilles qui aident à la capture des grains de pollen
Des études minutieuses ont montré que la charge de grains de pollen captée par le stigmate avait un fort impact sur le succès reproductif de l’espèce. Au delà de 400 grains de pollen, plus les stigmates reçoivent de grains et meilleure sera la fécondation des nombreux ovules de l’ovaire à deux loges : plus il y aura de graines viables et plus elles auront de chances de germer ; leur poids individuel ne varie pas mais leur qualité et quantité se trouvent largement dépendantes de ce facteur « charge effective de pollen ».
Un autre critère intervient dans la réussite de la fécondation : la qualité intrinsèque du donneur de pollen. Des expériences montrent que d’un pied donneur de pollen à l’autre, la qualité de la descendance de graines engendrées peut varier de manière considérable. On constate même que les « bons » individus pour le pollen ont eux-mêmes un faible succès en production de graines comme s’il y avait une certaine spécialisation individuelle au niveau du genre pour cette espèce pourtant hermaphrodite.
Protection ?
On a longtemps pensé que ce stigmate à lobes sensitifs servait de protection contre l’autopollinisation (dépôt du pollen des étamines d’une fleur sur son propre stigmate), mécanisme peu favorable pour le succès reproductif. Quand un insecte s’introduit dans le tube floral pour atteindre le nectar, il rencontre d’abord le stigmate ouvert et placé en avant sur lequel il dépose éventuellement du pollen d’une autre fleur qu’il a visité auparavant ; lors de son retrait en marche arrière, il récupère du pollen de la fleur en cours de visite et le stigmate replié entre-temps ne pourrait pas alors capter ce nouveau pollen. Sauf que plusieurs détails ne collent pas : la bignone de Virginie est surtout visitée par des colibris dans son pays d’origine au moins (voir ci-dessous) lesquels ne rentrent pas dans la fleur et ne la butinent que quelques secondes ; le temps de fermeture du stigmate dépasse largement le temps d’une visite d’insecte ; expérimentalement, si on dépose du pollen des étamines sur le stigmate de la même fleur, il germe et les tubes polliniques s’allongent normalement à l’intérieur du style pour atteindre les ovules ! Si on applique un mélange de particules de talc et de pollen venant d’une autre plante sur un stigmate donné, cela ne diminue pas les chances de fécondation : autrement dit, même si du pollen personnel se dépose sur son stigmate, cela ne concurrence pas du pollen étranger déposé par ailleurs.
La réalité s’avère même plus complexe encore : si expérimentalement, on dépose un mélange « d’auto-pollen » et de pollen étranger, le taux de fécondation des ovules augmente et jusqu’à 33% des graines viables alors obtenues proviennent d’autofécondation ! On parle d’autofertilité cryptique (autrement dit cachée) car il faudrait ce mélange pour assurer une production optimale de graines ! En fait, la protection contre l’autopollinisation existe bien mais à travers la position du stigmate en avant des anthères et la maturation décalée dans le temps (protandrie : anthères mûres avant le stigmate).
Syndrome
Aux USA, la bignone de Virginie est très connue comme plante à cultiver pour attirer des colibris à gorge rubis (Archilochus colubris), l’espèce présente sur une grande partie du territoire. Un pied florifère peut en attirer des dizaines à plusieurs kilomètres à la ronde. Pour les botanistes, la bignone offre effectivement tous les critères du « syndrome de la pollinisation par les colibris », i.e. un ensemble de traits a priori destinés à l’attraction de ces oiseaux comme pollinisateurs : les fleurs rouges, sans odeur avec un long tube floral un peu penché en avant, au sommet de pousses terminales ; l’absence de plate-forme d’atterrissage à l’entrée de la corolle (le colibri vole sur place devant la fleur) et un nectar abondant et dilué riche en sucrose.
- Deux exemples de fleurs nord-américaines pollinisées par les colibris : le penstemon à feuilles de pin
- .. et le « Fuchsia » de Californie (Epilobium canum)
La bignone de Virginie habite naturellement les lisières de forêts, les bords de rivières, les friches, le plus souvent en individus isolés, relativement espacés. Les colibris se déplacent chaque jour le long de ces corridors selon un circuit régulier (pratique dite du traplining) et trouvent chaque jour de nouvelles fleurs à butiner chez cette espèce à floraison très prolongée. La floraison connaît un pic initial marqué qui servirait à attirer les colibris locaux et à les inciter à passer par là chaque jour même si ensuite la production journalière de fleurs décline nettement. Effectivement, sur le terrain, la production de fruits chargés de graines viables atteint son maximum dans les zones fréquentées par des colibris. La tête des colibris dépose dix fois plus de charge de pollen sur le stigmate ouvert que la visite d’une abeille ou d’un bourdon : il aborde la fleur de face et avance (tout en volant sur place) sa tête à l’entrée pour plonger son bec et atteindre avec sa langue le nectar au fond du tube. Peut-être même que le stigmate fermé après le dépôt d’une charge suffisante de pollen sert de signal visuel perceptible (non démontré) pour indiquer que ce n’est pas la peine de venir butiner, la fleur ayant cessé de produire du nectar si elle a été fécondée. La production de nectar ne dure que 20 à 30 heures après l’ouverture mai la corolle persiste plusieurs jours, participant d’ailleurs à créer un fond coloré attractif.
Tout semble donc bien confirmer la réalité de ce syndrome : « ces fleurs sont faites pour les colibris » ! Belle phrase finaliste s’il en est ! Un peu trop simpliste pour être vraie, non ?
Sans les colibris ?
Aux USA, la bignone connaît une forte expansion hors de son aire naturelle originelle via son adaptation aux milieux perturbés engendrés par les activités humaines : cultures abandonnées ou en activité, talus de voies ferrées, friches, … On la considère désormais comme envahissante bien qu’autochtone ! Et pourtant dans ces nouveaux milieux ouverts où elle prospère et fructifie abondamment, se dispersant à grande distance via ses innombrables graines ailées libérées depuis les longues capsules à deux valves, les colibris ne viennent pas ou très peu ! Les fleurs reçoivent les visites essentiellement des abeilles domestiques et dans une moindre mesure des bourdons. Le même phénomène s’observe en Europe où l’espèce est largement cultivée (et commence même à se naturaliser un peu) et où il n’y a pas de colibris ! Ainsi en Pologne, une étude a été menée sur la pollinisation de ces bignones cultivées par les abeilles, les pollinisateurs les plus fréquents et de loin les plus efficaces.
- La bignone est très florifère et sa période de floraison s’étale sur une longue période
- Les graines ailées sont très légères et facilement dispersées par le vent
Contrairement aux colibris, les abeilles pénètrent jusqu’au fond de la fleur (l’entrée est large) et prélèvent aussi bien du nectar que du pollen. La charge moyenne de grains de pollen déposés par une abeille n’est que de … 44 grains/visite. Le pollen qu’elles récoltent pour emporter à la ruche est certes perdu mais leur nombre élevé compense leur piètre contribution. Au final, comme il faut un minimum de 800 grains de pollen/fleur pour obtenir une production optimale de fruits, la fructification reste un peu limitée mais pas plus qu’en situation naturelle avec les colibris bien plus rares.
Syndrome mal en point
Autrement dit, la bignone réputée fleur à colibris se montre tout autant fleur à abeilles dans d’autres circonstances ce qui met à mal le concept de syndrome qui prétend prédire le mode de pollinisation d’après les traits morphologiques ! Comment expliquer cette dissonance ? On sait déjà que chez nombre d’espèces de la famille des Bignoniacées, la production de nectar et sa composition dépendent plus de l’architecture de la fleur (dont la forme du nectaire, l’organe producteur de nectar) que des besoins des pollinisateurs dominants habituels : la contrainte morphologique l’emporte sur la supposée pression de sélection exercée par les pollinisateurs. Même en sites naturels avec des colibris, les fleurs des bignones reçoivent aussi des visites d’abeilles ; or, on prétend que les fleurs rouges ne sont pas perçues par les abeilles faute de perception visuelle dans cette gamme de couleur. En fait, cela ne concerne que les fleurs vraiment rouges qui ne sont pas si nombreuses. On oublie que nombre de fleurs possèdent souvent, en plus du fond rouge, des marques plus foncées (voir les rayures du tube de la corolle de la bignone) ou des « taches » devenant visibles en UV, ce que savent faire les abeilles. En fait, les fleurs rouges n’attirent pas spécialement les colibris mais elles seraient simplement moins visibles de la part des abeilles et donc plus disponibles pour les premiers !
- Entrée de la fleur : on devine des rayures sur la lèvre supérieure qui doivent servir de guides visuels pour les visiteurs.
Moralité de cette leçon : évitons de schématiser les relations entre êtres vivants, surtout dès lors qu’ils appartiennent à des groupes dont nous ne connaissons que partiellement le registre de perception sensorielle (côté animal).
Effet squatters
- Les fleurs attirent un grand nombre de petites fourmis qui recherchent le nectar
- Leur présence souvent en nombre a de quoi décourager les visites des abeilles !
- Fourmis installées sur des fleurs de bignone encore en boutons à cause des nectaires externes
- Même les capsules vertes portent des nectaires visités aussi par les fourmis !
La situation se complique encore plus avec la prise en compte d’autres visiteurs que abeilles et bourdons. Quiconque possède une bignone dans son jardin a du remarquer la présence quasi permanente et souvent en nombre de petites fourmis tant sur les fleurs que sur les fruits encore verts. Elles sont certes attirées par le nectar tout au fond de la corolle mais le plus souvent on les voit circuler et s’attarder sur le calice (y compris sur les boutons floraux) ou sur les gousses vertes ; un examen rapproché révèle la présence de sortes de glandes sécrétrices de nectar, des nectaires extra-floraux (dans le sens « pas dans la corolle ») ; pour en savoir plus sur ces petits organes très importants, nous conseillons la lecture d’une chronique de présentation générale. Ces fourmis se comportent en tout cas comme des « chiens de garde » et tendent à agresser les visiteurs ; elles peuvent donc décourager les visites des abeilles, notamment quand elles se tiennent dans la corolle en nombre. De plus, elles consomment un peu du nectar floral diminuant l’attractivité des fleurs.
Les perce-oreilles sont d’autres visiteurs fréquents dans les tubes des fleurs qui leur servent de refuge pour dormir de jour et éventuellement de garde-manger en grignotant aussi des anthères au passage. Leur présence pourrait aussi effrayer les abeilles et freiner leur activité. Enfin, un autre facteur important concerne la végétation proche des pieds de bignone : si une plante florifère et mellifère se trouve en pleine floraison en même temps que la bignone, elle peut très bien détourner à son profit les visites des abeilles ; ce phénomène a été observé en Pologne où un pied individuel de bignone n’a reçu aucune visite sur une saison dans un secteur riche en abeilles du fait de la présence proche d’un massif de bryone en pleine floraison !
Décidément, les processus naturels tels que la pollinisation ne se laissent jamais réduire à des schémas simples et nous imposent une certaine humilité dans nos jugements et appréciations !
BIBLIOGRAPHIE
- A Mechanism Facilitates Pollination due to Stigma Behavior in Campsis radicans (Bignoniaceae). YANG Shu-Xiang, YANG Chun-Feng, ZHANG Tao, WANG Qing-Feng. Acta Botanica Sinica 2004, 46 (9): 1071-1074
- BEES SUBSTITUTE BIRDS IN POLLINATION OF ORNITOGAMOUS CLIMBER CAMPSIS RADICANS (L.) SEEM. IN POLAND. I KOODZIEJSKA-DEGÓRSKA, MARCIN ZYCH. Vol. 75, No. 1: 79-85, 2006 ACTA SOCIETATIS BOTANICORUM POLONIAE