Une vie de tique
Ixodida
Dans la chronique Chasseurs de sang, nous avons fait connaissance avec l’anatomie de ces charmants arthropodes que sont les tiques ; nous avons exploré leur mode d’alimentation spécialisé : l’hématophagie, i.e. se nourrir du sang de vertébrés terrestres, dont les humains. A cette occasion, à plusieurs reprises, nous avons évoqué des liens étroits entre prise alimentaire et étapes du développement ainsi que les problèmes écologiques et comportementaux que cela leur posait. Dans cette nouvelle chronique, nous allons donc parcourir le cycle de vie des tiques du type Ixodes, celles qui en France au moins concernent le plus les humains comme Ixodes ricinus, la plus répandue. Ces tiques, qui appartiennent à la famille dite des « tiques dures », ne représentent qu’une part de la diversité de ce groupe qui nous évoquerons dans une troisième chronique consacrée à l’évolution au sein des tiques.
Rencontre
Chez toutes les tiques, les sexes sont séparés (gonochoriques). Mâles et femelles possèdent un orifice génital situé sous le corps entre la base (coxa) des pattes regroupées vers l’avant du corps. Chez les mâles des Ixodes, un clapet recouvre cet orifice alors que chez les femelles il reste ouvert. Dès qu’ils ont des organes sexuels actifs, aussitôt après la mue nymphale (voir ci-dessous), les mâles sont actifs et peuvent presque s’accoupler de suite ayant juste besoin d’un petit repas de sang pour mûrir leurs organes sexuels. Ils cherchent activement les femelles installées sur des hôtes ; chez certaines espèces, la rencontre peut se faire sur la végétation (lors des quêtes d’hôtes : voir Chasseurs de sang) ou, pour les espèces inféodées aux nids ou terriers, à l’intérieur de ceux-ci.
- Ixode vue de dessous ; cet individu doit être un mâle a priori : on voit l’orifice génital au niveau de la quatrième paire de pattes, fermé par un clapet
Quand il a trouvé une femelle, le mâle s’accouple mais peut ensuite rester sur cet hôte pour chercher d’autres femelles et s’accoupler avec elles, après avoir effectué un bref repas à chaque fois pour se reconstituer ! Au cours de l’accouplement, le mâle transfère dans l’orifice génital de la femelle un paquet de sperme ou spermathèque. Les femelles, par contre, ne s’accouplent qu’une fois avant d’entreprendre de s’implanter pour se nourrir (voir Chasseurs de sang).
La grande bouffe
La femelle fécondée va alors entamer un incroyable repas étalé sur des jours voire des semaines (voir chasseurs de sang) au cours duquel sa silhouette va plus que se métamorphoser ; elle va se gorger de sang et grossir, grossir, grossir, … ! Son poids initial va être multiplié de 200 à 600 fois au moins. Sa peau relativement rigide doit s’agrandir par divisions cellulaires actives et elle change de couleur virant au gris clair ; de ce fait, ce festin pantagruélique prend du temps car l’expansion de la peau doit suivre la prise de sang ! Selon l’environnement climatique, l’hôte, l’espèce de tique, ce repas peut prendre de 5 à 20 jours. Une fois le maximum atteint, la femelle méconnaissable, encore gorgée de sang, se détache de son hôte et se laisse tomber au sol. Là, elle achève de digérer son repas ce qui lui permet d’assurer la maturation complète des grappes ovariennes ; le sperme stocké est alors utilisé au fur et à mesure pour féconder les ovocytes. La femelle choisit un emplacement sur la végétation (donc jamais sur son hôte) et y dépose un énorme paquet de 2000 à 20 000 œufs en une seule fois. Et ensuite, … elle meurt !
Trois hôtes
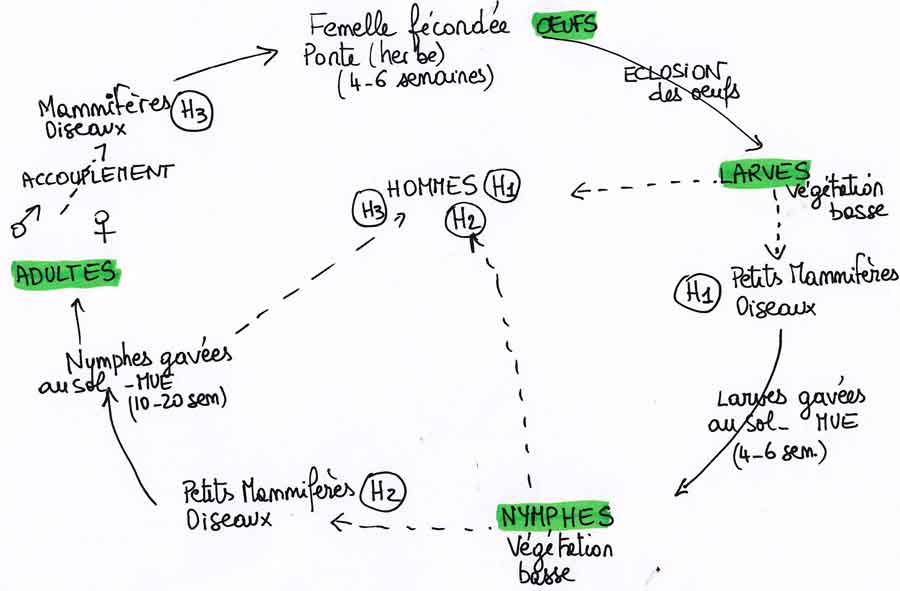
La grande majorité des tiques dures se caractérisent par un cycle de vie avec quatre stades successifs dont trois se passent sur trois hôtes individuels (mais souvent de la même espèce) différents. Prenons l’exemple classique de Ixodes ricinus, une des espèces les plus communes et qui adopte volontiers les humains comme hôtes.
A l’intérieur de chaque œuf, une petite larve se développe jusqu’à être prête à éclore au bout de qautre à six semaines ; cette étape requiert de la chaleur ce qui constitue l’un des facteurs limitants dans l’écologie des tiques. Mais, revers de la médaille, avec le réchauffement climatique, cette étape devient de plus en plus facile et rapide ce qui explique, entre autres, l’expansion actuelle des tiques.
La minuscule larve grimpe sur la végétation basse et se met en position de quête ; sa position basse correspond à un type d’hôte préférentiel : des petits rongeurs ou des oiseaux ; mais la jambe d’un humain de passage peut aussi faire l’affaire. Une fois ce premier repas accompli, la larve gorgée de sang se laisse tomber au sol et se cache dans la végétation pour muer. La larve est devenue une nymphe : elle a un peu grandi et ses organes sexuels se sont formés amis restent encore inactifs pour l’instant. Pendant une à deux semaines, leur peau molle les rend inactives et vulnérables jusqu’à ce qu’elle ait durci. Et c’est parti pour un second round de quête toujours dans la végétation basse. La nymphe gorgée de sang se laisse tomber au sol, mue et devient un adulte, mâle ou femelle. Après une nouvelle phase d’attente pour le durcissement de la peau, les adultes grimpent cette fois en général dans de la végétation plus haute à la recherche d’hôtes plus grands (mammifères sauvages). Et ainsi, on aboutit à l’étape de l’accouplement décrite dans le premier paragraphe.
Une vie chao… tique
On comprend, au vu du déroulement de ce cycle en trois actes avec à chaque fois changement d’hôte, que çà ne va pas être simple. Les larves, comme les nymphes et les adultes doivent impérativement trouver un hôte adéquat et y prélever leur ration de sang pour passer à l’étape suivante. Ceci explique qu’un tel cycle dure au moins six mois dans le meilleur des cas mais peut aussi s’étaler sur plusieurs années (jusqu’à six ans !) selon l’environnement climatique, la densité des hôtes potentiels, la végétation, …
En plus de l’aléa « trouver un hôte à chaque fois », il faut aussi éviter les prédateurs au sol lors des phases de mue ou lors des phases d’attente très exposées en position de quête. L’hôte peut aussi réussir à se débarrasser de la tique implantée par toilettage ou en se roulant dans la boue pour les mammifères. Dans les pays tropicaux, des oiseaux se sont spécialisés sur cette source de nourriture tels que les pique-bœufs, passereaux proches des étourneaux (famille des Buphagidés).
- Pique-boeuf africain sur un buffle au Kenya (photo D. Bermudez)
L’hôte peut aussi réagir par voie physiologique via son système immunitaire. C’est là que l’arsenal chimique injecté par la tique (voir Chasseurs de sang) s’avère déterminant : l’anesthésiant évite que l’animal ne réagisse lors de l’implantation ; les immunosuppresseurs vont atténuer les réactions internes ; …
On comprend mieux l’intérêt de cette ponte colossale de plusieurs milliers d’œufs pour espérer qu’au final quelques adultes réussiront à engendrer une nouvelle descendance !
Hôtes
Si les espèces inféodées aux terriers ou aux nids peuvent s’offrir le luxe d’une certaine spécificité car presque assurées de trouver un hôte au fil de leur cycle, celles qui adoptent la technique de la quête à l’air libre ne peuvent guère se le permettre. Ces aléas expliquent sans doute ainsi la faible spécificité générale de nombre de ces espèces. Ainsi, Ixodes ricinus peut aussi bien parasiter des oiseaux, des petits mammifères (surtout des rongeurs), des oiseaux, des grands mammifères (chevreuils, cerfs, bétail) que des humains. Ainsi, les chances de croiser un hôte à chaque étape s’en trouvent largement augmentées. D’ailleurs, un autre facteur qui explique l’expansion du problème tiques pour les hommes, c’est la fréquentation croissante des humains dans les milieux naturels via les loisirs et le tourisme ou les habitations à la campagne. Certaines espèces réussissent quand même à être spécifiques comme la tique brune du chien (Rhipicephalus sanguineus) qui ne parasite pratiquement que les chiens mais plutôt en région méditerranéenne, son berceau d’origine ; mais elle bénéficie de leur nombre croissant dans l’environnement !
Cependant, Ixodes ricinus n’est peut-être pas si généraliste qu’il n’y paraît. Une étude génétique (3) conduite dans différents pays européens sur des tiques I. ricinus prélevées sur divers hôtes suggère l’existence de populations relativement spécialisées sur des types d’hôtes et indiscernables morphologiquement.
Dispersion et répartition
De nombreuses études ont été menées sur l’écologie de I. ricinus, l’espèce la plus répandue et la plus problématique comme vecteur de la borréliose ou maladie de Lyme. Cette espèce reste avant tout inféodée aux boisements. Cependant, (4), les déplacements des hôtes (dont les mammifères sauvages) depuis les boisements vers les prairies induisent une dispersion des tiques (larves, nymphes ou adultes) vers les prairies où leurs chances de survie sont limitées ; mais, néanmoins, cet apport permanent suffit à augmenter le risque pour les humains d’être parasités lors de passages dans les grandes herbes. Les vaches qui broutent les bordures transfèrent aussi beaucoup de tiques en allant ensuite pâturer dans le pré selon l’heure de la journée.
En termes de dispersion, les oiseaux semblent aussi jouer un rôle majeur compte tenu de leurs capacités de déplacement à grande échelle. Dans des forêts d’Ile-de-France, (7) on a montré que les oiseaux de taille moyenne se nourrissant au sol sont les plus porteurs de tiques ; quatre espèces concentrent ainsi 90% des tiques : le merle noir, la grive musicienne, le rouge-gorge et le troglodyte. L’abondance du merle noir notamment et sa propension à fréquenter les milieux anthropisés laisse à penser qu’il pourrait jouer un rôle majeur dans la propagation des tiques.
Sur des sites touristiques très fréquentés (5), on a montré que les densités étaient beaucoup plus élevées à proximité des arbres (jusqu’à 5 fois plus) ; mais, quand même, on trouve des tiques dans l’herbe rase près des parkings ; or, ces lieux servent souvent de sites de pique-nique : ainsi, bien que peu habités par les tiques, leur surfréquentation humaine en fait des sites à haut risque ! L’étude montre aussi que les tiques s’accrochent souvent au niveau du bas des jambes (les adultes encore plus que les nymphes) ; avis donc aux promeneurs à utiliser des pantalons resserrés au niveau de la cheville et à les traiter en priorité avec un répulsif !
Une étude détaillée (6) dans une réserve naturelle allemande montre que la répartition des tiques dépend de divers facteurs climatiques dont la température, l’humidité relative, la teneur du sol en eau et le type de végétation. Certaines communautés végétales identifiées hébergent les plus fortes densités de tiques ; elles ne se répartissent donc pas au hasard dans le milieu forestier. Au cours des 20 dernières années, une forte croissance des populations a été observée en lien avec le changement climatique global mais avec le nombre croissant de sangliers, hôtes très parasités par les tiques.
BIBLIOGRAPHIE
- Ticks of Australia. The species that infest domestic animals and humans. STEPHEN C. BARKER & ALAN R. WALKER. Zootaxa 3816 (1): 001–144. 2014
- Ticks and Tickborne Bacterial Diseases in Humans: An Emerging Infectious Threat. Philippe Parola and Didier Raoult. Clinical Infectious Diseases 2001;32:897–928
- Host races in Ixodes ricinus, the European vector of Lyme borreliosis. Florent Kempf et al. Infection, Genetics and Evolution 11 (2011) 2043–2048
- Influence of host migration between woodland and pasture on the population dynamics of the tick Ixodes ricinus : A modelling approach. T. Hoch, Y. Monnet, A. Agoulon. Ecological Modelling 221 (2010) 1798–1806
- Tick (Ixodes ricinus) abundance and seasonality at recreational sites in the UK: Hazards in relation to fine-scale habitat types revealed by complementary sampling methods. Andrew D.M. Dobson, Jennifer L. Taylor, Sarah E. Randolph. Ticks and Tick-borne Diseases 2 (2011) 67–74
- Analysis of the distribution of the tick Ixodes ricinus L. (Acari: Ixodidae) in a nature reserve of western Germany using Geographic Information Systems. Alexandra Schwarz et al. Int. J. Hyg. Environ. Health 212 (2009) 87–96
- Which forest bird species are the main hosts of the tick, Ixodes ricinus, the vector of Borrelia burgdorferi sensu lato, during the breeding season? M. Marsot et al. International Journal for Parasitology 42 (2012) 781–788