Le houx, une essence climato-sensible
Ilex aquifolium
Face au grand changement climatique global en cours, on sait que toutes les espèces végétales ne sont pas soumises aux mêmes challenges selon, notamment, leur capacité d’adaptation à moyen terme par évolution ou par variation individuelle (plasticité : voir ci-dessous). Certaines d’entre elles peuvent se montrer très sensible à tel facteur climatique justement très affecté par le changement climatique en cours. Les effets vont alors se faire sentir en priorité et avec une intensité maximale aux limites de la répartition actuelle de l’espèce, là où elle réussit à se maintenir sans pouvoir aller au-delà. C’est le cas du houx commun, arbre bien connu de nos forêts tempérées. D’ores et déjà, on peut observer une expansion de sa répartition aux limites nord de sa répartition Europe en Scandinavie et prédire une régression, voire une quasi-extinction aux limites méridionales de son aire, comme dans le centre montagneux de l’Espagne. Des recherches en cours permettent de comprendre les difficultés ou au contraire les avantages que le houx rencontre face au changement global.
Exigences
Au niveau des sols, le houx se montre relativement éclectique avec une large amplitude : il peut croître sur des sols variés en composition chimique avec une préférence pour les sols plutôt acides ; il peut réussir sur calcaire mais à condition que le sol soit frais et il craint les argiles compactes. Par contre, au niveau des exigences climatiques, il se montre plus exigeant avec des contradictions apparentes. S’il résiste à de très basses températures (jusqu’à – 20°C) et monte en altitude jusque dans l’étage subalpin, il ne se montre pas moins sensible aux basses températures surtout au stade plantule ce qui agit sur sa capacité de régénération. Mêmes les adultes connaissent des difficultés en hiver, surtout au niveau des feuilles exposées en pleine lumière : elles subissent une forte réduction de leur capacité à faire la photosynthèse (photoinhibition) mais peuvent revenir rapidement à une activité normale dès qu’elles se retrouvent plus à l’ombre et moins à la lumière (1).
- Autre habitat classique : chênaie océanique
- En lisière, ces houx restent abrités au pied des grands hêtres
- Le houx peut se développer sous l’ombre pourtant forte du hêtre
La lumière, voici justement l’un des deux facteurs clés pour comprendre l’écologie du houx. Il se comporte globalement comme une espèce d’ombre (dite sciaphile) croissant surtout en situation de sous-bois, tout en étant capable de survivre en pleine lumière pour des individus isolés et déjà bien implantés. L’autre facteur clé concerne l’humidité atmosphérique : il recherche clairement les stations installées sous un climat de type océanique, bien arrosé et plutôt doux ou montagnard pas trop froid mais toujours bien arrosé.
Héritage
Cette exigence d’humidité a de quoi surprendre quand on voit le feuillage coriace, épineux, persistant qui rappelle celui de nombre d’arbustes méditerranéens adaptés à la sécheresse (comme le chêne kermès par exemple). Pour comprendre cette contradiction apparente, il faut remonter dans le temps et explorer l’histoire du genre Ilex, seul représentant dans sa famille, les Aquifoliacées (2). Ce genre sub-cosmopolite compte près de 600 espèces surtout réparties en Amérique tropicale (300 espèces avec notamment le célèbre maté) ou en Asie du sud-est (250 espèces) ; pour le reste, on a 30 espèces en Amérique du nord ; seulement 4 espèces persistent en Europe : le houx commun, le houx de la Mer noire (I. colchica) et deux espèces endémiques des îles de Macaronésie (I . perado et I. canariensis)
Ce genre a connu une période de diversification majeure à cheval sur la fin du Crétacé (fin du secondaire) et sur la première moitié du Tertiaire avec une apogée au Miocène. Tous les houx actuels partagent un ancêtre commun qui date de cette dernière époque. Ils font partie d’un assemblage de plantes qui occupait majoritairement l’Hémisphère nord durant cette période sous un climat bien plus chaud proche du climat tropical humide (on parle de flore arcto-tertiaire). On connaît ainsi des fossiles de houx en Alaska ou en Islande. A la fin de l’ère Tertiaire, avec la nette dégradation climatique (refroidissement) annonciateur des glaciations quaternaires, le genre a été décimé mais certaines espèces ont trouvé refuge soit sur des îles atlantiques (comme aux Canaries, à Madère ou aux Açores), soit pour notre houx sur le continent mais sous un climat présentant une affinité avec ses anciennes origines.
Au Nord
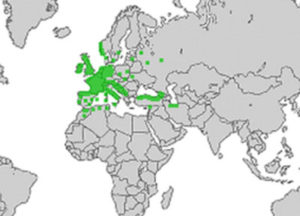
- Carte de répartition du houx (il a été introduit hors Eurasie)
Dès 1944, une étude approfondie conduite en Scandinavie avait permis de constater que la limite nord de répartition du houx avec l’isotherme 0°C de janvier, une ligne climatique virtuelle qui relie tous les points où la moyenne de janvier est de 0°C. Cinquante ans plus tard, une équipe a repris la cartographie du houx ainsi que celle de données climatiques (3). Elle confirme le réchauffement global en cours puisqu’un réchauffement de 0,6 à 1°C par décade entre 1976 et 2000 est mesuré dans le sud de la Scandinavie en ce qui concerne les températures hivernales. L’isotherme 0°C de janvier s’est nettement déplacée vers le nord notamment dans le golfe de Botnie mais le houx a suivi cette migration nordique et reste contenu par cette limite mouvante. Au Danemark, une étude du même genre aboutit aux mêmes conclusions : le houx a progressé nettement à l’est de son ancienne limite d’environ 100 kilomètres en quarante ans !
Vu la sensibilité du houx au froid hivernal, on peut donc bien avancer que ce changement de répartition tient à l’accroissement global des températures hivernales qui accroissent l’aire potentielle où le houx peut se propager.
La main de l’homme
On pourrait aussi invoquer l’influence indirecte de l’homme qui modifie les milieux de vie (gestion des milieux forestiers, transformations des paysages) ou plante des houx comme arbres ornementaux notamment dans les villes et villages. Au Danemark, 70% des habitats sont d’apparence naturelle essentiellement dans des forêts et 92% des arbres recensés lors de l’étude (4) sont non plantés ce qui tempère ces hypothèses. Une autre étude menée au Danemark s’est intéressée à la part des plantations artificielles de houx dans l’expansion géographique du houx. Trois cultivars de houx très souvent plantés dont celui à fruits jaunes (bacciflava) ont été suivis par rapport à la consommation des fruits par les oiseaux, agents de dispersion des graines dans les excréments par endozoochorie (voir la chronique sur ce mode de dispersion).
- Fruits charnus bien connus du houx
- Jeune houx installé sur une vieille souche ; s agraine a du être apportée par un oiseau qui a déposé ses excréments après avoir consommé des fruits
Les cultivars à fruits rouges semblent les plus prisés et 80% de leurs fruits disparaissent en deux mois d’hiver ; le cultivar à fruits jaunes est par contre nettement délaissé (35% des fruits enlevés). Les « fuites » depuis les jardins urbains et campagnards peuvent donc contribuer à la progression générale du houx et l’accélérer. La barrière thermique ne v pas forcément agir de la même manière car il s’agit souvent de cultivars sélectionnés pour leur résistance au froid ! Aux U.S.A. sur la côte Pacifique, le houx commun a été introduit à la fin du 19ème comme ornemental ; il s’est facilement échappé des jardins et est devenu un arbre nettement invasif dans les forêts côtières où il domine les sous-bois en fourrés denses. Il a trouvé là un climat doux et arrosé qui lui convient bien !
- Cultivar « Pyramidalis » dans un parc et couvert de fruits
- Cultivar à feuillage panaché
- Cultivar à fruits jaunes
- Hybride (x altaclerensis) issu du croisement de aquifolium avec perado ; très vigoureux et susceptible de se répandre dans la nature ?
Au Sud
Partons maintenant à l’opposé, vers la limite sud de répartition du houx en Europe qui se situe dans les régions montagneuses du nord-ouest et du centre de l’Espagne. On y trouve des peuplements presque purs de cette essence, gérés depuis des siècles par les hommes (notamment comme fourrage pour le bétail) ou en sous-bois de forêts de chênes ou de hêtres. Le houx croît ici sous un climat continental nettement plus sec en été avec des périodes de sécheresse estivale parfois prononcées et prolongées. Diverses études (5, 6) montrent que, dans ces régions, le houx devient une essence strictement sciaphile (d’ombre) alors que ce comportement reste facultatif en climat océanique où on peut par exemple le trouver hors des bois dans les haies des bocages ou dans les landes. La survie des plantules dans ces milieux méditerranéennes dépend nettement de leur ombrage relatif : elle atteint un maximum pour un éclairage relatif au sol de 12%, devient très faible pour un ombrage presque total et nulle en plein soleil. Les adultes se montrent aussi sensibles aux sécheresses au niveau de leur feuillage mais peuvent surmonter ces épreuves s’ils sont bien implantés.
- Le houx peut croître en pleine lumière notamment dans les haies des bocages sous climat favorable
- Dans les boisements, il colonise les clairières et supporte la pleine lumière qui ne va durer qu’une courte période.
On a étudié la plasticité phénotypique de ces houx, i.e. la capacité d’un individu (un génotype) d’exprimer une gamme de formes possibles (phénotypes) en réponse à la variation de l’environnement. Autrement dit, l’individu peut, au cours de sa vie modifier sa morphologie, sa physiologie, son comportement ou son histoire de vie en réponse à un changement dans son environnement : il s’agit d’une propriété présente chez tous les êtres vivants. On constate que les houx peuvent varier un peu au niveau morphologique (taille des feuilles par exemple) mais se montrent incapables de varier sur le plan physiologique. Si on les soumet au double stress de la sécheresse et de l’ombre totale, ils résistent nettement moins bien qu’une autre essence qui préfère aussi l’ombre moyenne, le hêtre. En Belgique, sous un climat très favorable pourtant, le houx est en train de se faire éliminer dans nombre de boisements par une espèce invasive introduite, le rhododendron, qui lui présente une forte plasticité physiologique et devient ainsi très compétitif.
Dans le cadre du réchauffement climatique global avec l’accentuation probable des périodes de forte sécheresse en Espagne, l’avenir de ces populations s’avère donc compromis et l’espèce devrait a minima voir son aire naturelle se rétrécir. Or, dans les milieux où il domine, le houx constitue une espèce clé de voûte qui par son feuillage persistant et ses fruits sert d’abri et de nourriture à nombre d’animaux : l’écosystème forestier risque donc d’être globalement affecté.
- Contrairement aux apparences, le feuillage du houx plaît à de nombreux animaux : ici, le strates du passage d’une chenille
- Là, les mines creusées par les larves d’une mouche
- Houx brouté par des cervidés et prenant un port ramassé touffu avec de nombreuses feuilles
- Les jeunes feuilles de l’année sont plus tendres quand elles émergent !
Embolie
- Le houx est un arbre au tronc bien développé
- Tronc avec son écorce typique, bigarrée par les lichens incrustés
Une autre menace pèse sur les houx soumis aux fortes sécheresses : la cavitation entraînant une embolie. L’arbre ayant du mal à se procurer de l’eau dans le sol, sa sève brute a du mal à circuler dans les vaisseaux du bois conducteur (le xylème) et des bulles d’air peuvent apparaître et provoquer une embolie gazeuse. La sève cesse d’alimenter la partie affectée qui meurt et sèche. Une étude a été conduite en Suisse sur des houx installés dans deux sites très contrastés du point de vue climatique : un site tempéré assez humide et un site sec et chaud en été. L’étude des cernes de croissance de ces houx a permis de suivre l’évolution de leurs vaisseaux depuis presque un siècle. Sur les deux sites, on observe des changements nets dans les vaisseaux du xylème : leur fréquence augmente et ils tendent à se regrouper de manière plus étroite ce qui serait un moyen de limiter les risques d’embolie gazeuse. Cette tendance est encore plus affirmée sur le site sec. Ceci montre que sous la pression du réchauffement global, les houx changent en modifiant leur architecture interne de vaisseaux conducteurs. Parallèlement, on observe que sur le site sec notamment, cette évolution se fait au détriment de la croissance en diamètre : autrement dit, les houx redistribuent les matières carbonées qu’ils élaborent par photosynthèse plutôt vers la construction de vaisseaux plus résistants aux problèmes liés aux sécheresses que vers la croissance.
Le houx semble donc quand même disposer de capacités de réaction mais dans quelle mesure ces transformations ne vont-elles pas modifier sa capacité à supporter la compétition des autres espèces : à trop se « serrer la ceinture » il risque de se faire dépasser rapidement par d’autres espèces ligneuses moins affectées !
BIBLIOGRAPHIE
- Photoinhibition of holly (Ilex aquifolium) in the field during the winter. Quentin J. Groom, Neil R. Baker ; Steve P. Long Physiologia Plantarum Vol. 83, Issue 4, p. 585–590, 1999.
- Towards an understanding of the distribution of Ilex L. (Aquifoliaceae) on a World-wide scale. LOIZEAU, P.-A., BARRIERA, G., MANEN, J.-F. & BROENNIMANN, O. 2005. Biol. Skr. 55: 501-520.
- An ecological ‘footprint’ of climate change. Gian-Reto Walther, Silje Berger and Martin T. Sykes. Proc. R. Soc. B (2005) 272, 1427–1432
- Modelling the distribution of Ilex aquifolium at the north-eastern edge of its geographical range. Baiiuelos, M. J., Kollmann, J., Hartvig, P. Quevedo, M. 2004. Nord. J. Bot. 23: 129-142.
- Dispersal limitation at the expanding range margin of an evergreen tree in urban habitats? Linda A. Møller, Anne-Marie T. Skou, Johannes Kollmann. Urban Forestry & Urban Greening 11 (2012) 59–64
- Shade tolerance, photoinhibition sensitivity and phenotypic plasticity of Ilex aquifolium in continental Mediterranean sites. F. VALLADARES et al. Tree Physiology 25, 1041–1052 . 2005
- Limited capacity to cope with excessive light in the open and with seasonal drought in the shade in Mediterranean Ilex aquifolium populations. Ismael Aranda et al. Trees (2008) 22:375–384
- Functional adjustments of xylem anatomy to climatic variability: insights from long-term Ilex aquifolium tree-ring series. Angelo Rita et al. Tree Physiology 35, 817–828 ; 2015