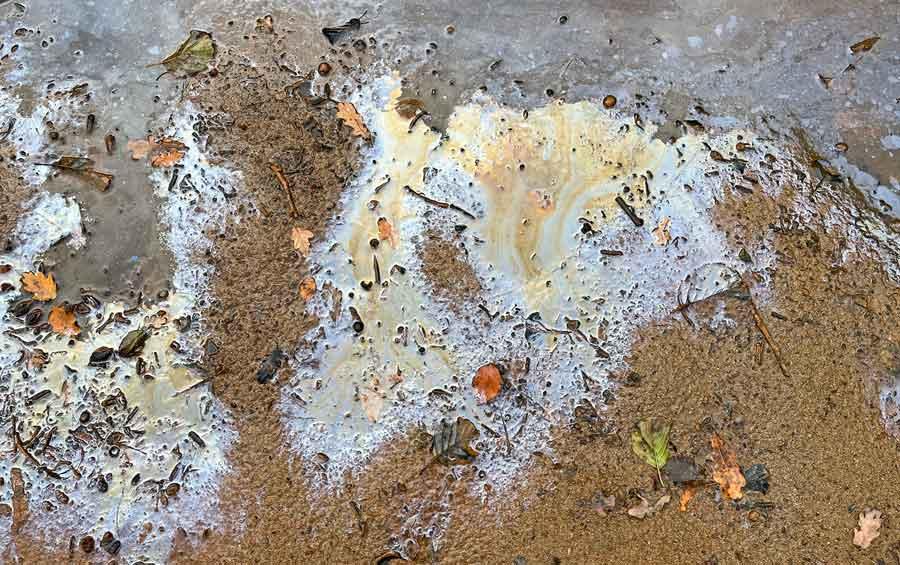Ocre et irisations : les ferrobactéries en action
11/11/2022 Avec des températures anormalement chaudes qui ont perduré et l’absence de précipitations, cet automne a offert des conditions idéales pour le développement de certains microorganismes des eaux stagnantes, les ferrobactéries, dont l’activité intense se manifeste de manière spectaculaire de deux manières : soit sous forme d’une boue orangée gélatineuse qui entoure la végétation immergée et qu’on appelle l’ocre ferreuse ou rouille des marais ; soit sous forme de films huileux flottant à la surface de l’eau avec souvent des irisations remarquables.
Le non-initié interprète le plus souvent ces manifestations inhabituelles et ponctuelles comme un signe de pollution chimique provoquée par l’homme (surtout les films huileux qui font penser à de l’essence sur l’eau). Or, il n’en est rien et ces dépôts résultent de l’activité de bactéries naturellement présentes dans les milieux aquatiques et qui « se nourrissent » du fer dissous dans l’eau, un élément abondant dans la nature.
Un peu de chimie
Pour que l’ocre ferreuse ou rouille des marais se forme, il faut d’abord du fer dissous dans l’eau. Ceci n’est pas un problème car le fer est un élément minéral très répandu dans la nature aussi bien dans les sols (issu de la décomposition des roches qui renferment cet élément) que dans les eaux et notamment les eaux souterraines. Pour bien comprendre les processus en jeu, nous allons d’abord passé par un peu de chimie, en restant très simple. Le fer se présente dans l’environnement sous deux formes chimiques : le fer ferrique, l’ion (Fe 3+) des chimistes et le fer ferreux, (Fe 2+) ; ils diffèrent par leur nombre d’électrons : le fer ferrique peut gagner un électron pour devenir du fer ferreux et inversement le fer ferreux peut perdre un électron et redevenir du fer ferrique. Ces passages de l’un à l’autre se font soit de manière spontanée dans des conditions de milieu particulières (pH, taux d’oxygène, …), soit par l’intervention de microorganismes dont les ferrobactéries. Un point capital change tout : le fer ferreux est soluble dans l’eau alors que le fer ferrique y précipite sous forme solide dès que le pH (acidité) baisse.
La réaction chimique à l’origine de l’ocre ferreuse, qu’elle soit due à des ferrobactéries (réaction biologique) ou par réaction chimique peut se résumer ainsi :
Les oxydes de fer ainsi formés se complexent avec des substances organiques dissoutes dans l’eau et donnent ces masses floculeuses gélatineuses qu’on appelle l’ocre ferreuse.

Cette réaction peut tout aussi bien avoir lieu dans l’autre sens : on parle de réduction chimique. L’élément clé qui oriente la réaction dans le sens ci-dessus est l’oxygène qui capte les électrons du fer ferrique (voir ci-dessus) : on parle d’oxydation. Il faut un minimum d’oxygène (avec ou sans les bactéries) pour cette réaction ait lieu dans ce sens.
Où et quand ?
Un certain nombre de conditions doivent être réunies pour que l’ocre ferreuse se forme. Premièrement, il faut une eau stagnante ou qui coule très lentement. Donc, l’ocre ferreuse s’observe dans les milieux d’eau stagnante essentiellement : fossés, marais, flaques d’eau permanentes en forêt, bords de plans d’eau, ruisseaux à écoulement lent.

Berge d’un lac avec un suintement ferrugineux 
Petit fossé attenant à un ruisseau 
Trou d’eau dans un marais à joncs 
Fond d’un fossé en bocage
Deuxièmement, il faut une eau contenant du fer ferreux dissous que les ferrobactéries vont oxyder en fer ferrique. Le plus souvent, il s’agit d’une eau qui a séjourné longtemps sous terre dans des conditions anaérobies, i.e. en quasi absence d’oxygène ; là, d’autres bactéries réduisent les oxydes de fer du sol au contact de l’eau et libèrent ainsi du fer ferreux soluble qui peut circuler. Les endroits où cette eau va ressortir à l’air libre deviennent alors des sites privilégiés pour de développement des ferrobactéries : suintements sur des pentes, trous d’eau au cœur des marais ou des tourbières (gouilles). Cette condition se retrouve aussi autour des fonds vaseux de plans d’eaux, chargés en matière organique qui consomme beaucoup d’oxygène pour sa décomposition et créée ainsi des conditions anoxiques (sans oxygène). Ce peut être aussi à l’exutoire d’un étang ou barrage avec un écoulement lent : l’eau qui sort venant du fonds a subi cette transformation favorable. Enfin, il y a le cas très particulier des sources très minérales chargées en fer.
Signalons au passage que la formation d’ocre ferreuse peut être très forte dans certains aménagements artificiels créés par l’Homme : drains des cultures où circule une eau pauvre en oxygène, puits de captage, canalisations ; là, le dépôt d’ocre ferreuse peut être très important et entraîner de gros problèmes d’obturation et/ou de corrosion. Nous n’évoquerons pas plus cet aspect en nous concentrant sur les milieux naturels mais la littérature scientifique regorge de publications techniques liées à cet inconvénient.
Mais, quand cette eau arrive à l’air libre, les ferrobactéries se trouvent confrontées à une contrainte forte : si l’eau n’est pas trop acide (pH proche de la neutralité), cas le plus fréquent, l’oxygénation de l’eau au contact de l’air favorise très vite l’oxydation spontanée du fer ferreux (réaction non biologique) et les ferrobactéries se trouvent très vite évincées, privées de leur substrat nutritif. Elles ne se développent donc que si il y a juste un peu d’oxygène (moins de 1 mg/l) leur permettant de ne pas être concurrencées ; de ce fait, elles se trouvent confinées dans une niche étroite, celle des bactéries dites microaérophiles qui tolèrent peu d’oxygène dans une eau immobile par opposition aux bactéries dites aérobies qui vivent dans des eaux qui coulent avec des taux d’oxygène bien supérieurs ou aux bactéries anaérobies (celles qui transforment le fer dans les eaux souterraines : voir ci-dessus).
De pair avec ce qui précède, certaines conditions météorologiques vont favoriser la mise en place de telles conditions : un temps chaud et sec prolongé avec des eaux stagnantes qui s’échauffent et perdent de l’oxygène ; l’absence prolongée de précipitations car les fortes pluies provoquent des écoulements et la mise en mouvement de l’eau qui s’oxygène ainsi qu’une dilution des substances dissoutes. D’ailleurs, même aux endroits où ponctuellement on observe parfois des dépôts conséquents, voire spectaculaires, les premières fortes pluies les font disparaître très rapidement.
Tout ceci explique la relative rareté de la formation d’ocre ferreuse dans la mesure où il faut la conjonction de conditions spatiales et temporelles assez précises.
Galionella ferruginea
Pour mieux comprendre ce processus, nous allons entrer dans l’intimité d’une des ferrobactéries responsables de la formation d’ocre ferreuse parmi les plus fréquentes : Gallionella ferruginea.
Au microscope (très fort grossissement), ces bactéries apparaissent sous forme de cellules en forme de haricot qui se développent au bout d’une structure organique enroulée en hélice qu’on appelle une tige. Celle-ci, secrétée par les bactéries, se compose de polysaccharides (sucres du même type que l’amidon par exemple) ; elle serait une structure de survie et de protection : les oxydes de fer engendrés par l’activité bactérienne s’y déposent préférentiellement ce qui évite aux bactéries de se trouver « minéralisées » et englobées dans ce dépôt. Plus ces bactéries se développent, plus elles produisent ces « tiges » ce qui conduit rapidement à la formation de ces masses floculeuses et gélatineuses (du fait de la présence de polysaccharides).

Aspect floculeux 
Aspect gélatineux visqueux 
Croûte en surface 
Banc épais mais très « mou » facile à désorganiser
Gallionella oxyde donc le fer ferreux en fer ferrique en présence de lumière ce qui lui permet de récupérer ainsi de l’énergie dont elle va se servir pour fabriquer ses ressources alimentaires propres. En effet, comme les plantes vertes, ces bactéries peuvent capturer le dioxyde de carbone de l’air à partir det l’assimilent en molécules organiques dont elles ont besoin. Elles sont donc autotrophes, i.e. autonomes pour leur alimentation. Cependant, dans des eaux enrichies en matière organique dont des sucres, elles peuvent aussi prélever directement ces molécules pour s’en nourrir et se comportent alors en hétérotrophes opportunistes. Cette dualité leur permet de mieux survivre dans des eaux temporairement pauvres en nutriments organiques.
L’oxydation du fer ferreux génère assez d’énergie à pH neutre pour permettre la multiplication des bactéries ; si le pH s’acidifie (en-dessous de 6) ou si l’oxygène vient à passer en-dessous du seuil minimal pour fonctionner en mode microaérobie (voir ci-dessus), elles cessent de fabriquer ces tiges et de se multiplier. Inversement, quand les conditions sont favorables, elles ne cessent de produire de nouvelles tiges qui fixent au fur et à mesure le fer ferrique.
Il existe en fait de nombreuses autres espèces dans des genres divers capables de fonctionner de même. Ainsi Leptothrix ochracea produit des étuis ou gaines filamenteuses qui fixent le fer et engendrent elles aussi une ocre ferreuse (d’où le partage de l’épithète latin ochracea).
Irisations
Dans les mêmes types de sites et régulièrement en présence de dépôts d’ocre ferreuse, on observe à la surface des eaux concernées d’étranges voiles huileux d’une teinte bleutée qui n’est pas sans rappeler celle engendrée par une pollution d’hydrocarbures. Mais ici il s’agit d’un film naturel très différent : si on le touche (il n’y a aucun danger) il se « brise » en morceaux et ne se reforme pas aussitôt comme une tache d’huile ou d’essence sur l’eau.
Ces films résultent là aussi de l’activité de ferrobactéries différentes dont Leptothrix discophora. Ils se composent de diverses substances organiques (sucres, matières grasses, protéines) issues de l’activité des bactéries planctoniques vivant en colonies juste sous la surface (au plus près de l’oxygène). Au départ, un petit groupe de bactéries (des dizaines de milliers disons … car avec les bactéries les chiffres des populations sont astronomiques) s’agglomère et secrète des protéines leur permettant de « s’accrocher » à l’interface eau/air. Très vite, si les conditions (pH, eau calme, oxygène) sont favorables, elles prolifèrent et la colonie forte de milliards de bactéries constitue une matrice épaisse huileuse (du fait de la présence de lipides) qui flotte en surface. En plus, ces films attirent toute une série de commensaux ou prédateurs microscopiques : champignons, virus, algues, protozoaires ; bref, on a là un microécosystème flottant autonome. Ce superorganisme développe des propriétés physiques et chimiques qui protègent ses bâtisseurs des UV, de divers polluants, …

Panneau pédagogique au bord du lac Chambon (63) (voir Biblio) 
Irisations dans l’aulnaie juste à côté du panneau
Souvent, on repère ces films de loin à cause de la présence d’irisations parfois spectaculaires du plus bel effet. Elles résultent de l’interférence de la lumière incidente avec la surface du film ; une partie traverse le film et est renvoyée ce qui induit des décalages dans la propagation des différentes longueurs d’ondes qui composent la lumière blanche : certaines couleurs se trouvent renforcées comme les bleus à la manière de ce qui se passe sur les bulles de savon que l’on souffle en l’air.

Ce film finit par vieillir et se dessécher : il se plisse en surface avec des fronces et finit par disparaître.
Impacts

Le développement de l’ocre ferreuse en milieu naturel interroge le naturaliste qui se demande si cela ne finit pas « empoisonner » le milieu mais avec le sentiment qu’on se laisse surtout abuser par l’aspect coloré et gélatineux. Pourtant, les conséquences semblent assez limitées quant aux impacts sur la petite faune aquatique. Une étude américaine a testé via des expériences sur le terrain les réactions d’une dizaine de larves d’insectes aquatiques installées au milieu de dépôts d’ocre ferreuse dans des ruisseaux. Sur les six cours d’eau étudiées, cinq étaient nettement plus pauvres en faune au niveau des zones à ocre ferreuse. Trois espèces de larves d’éphémères montrent une mortalité accrue si on les met dans des cages au milieu de ces dépôts mais inversement, cinq espèces de larves de phryganes (« porte-faix ») ne subissent aucun impact négatif. Dans des expériences de tests de choix, cinq espèces évitent les sites englués d’ocre mais trois autres non. Deux espèces se montrent capables de se nourrir des bactéries mais avec une croissance diminuée, une est indifférente et se développe aussi bien que dans un milieu sans ocre et une dernière se montre incapable de s’en nourrir. On voit donc que l’ocre ferreuse a des effets très variés sur les diverses espèces de la faune des larves d’insectes aquatiques selon leur capacité à consommer ces bactéries, à accepter ou pas ces zones comme lieux de vie ou à résister à l’étouffement.
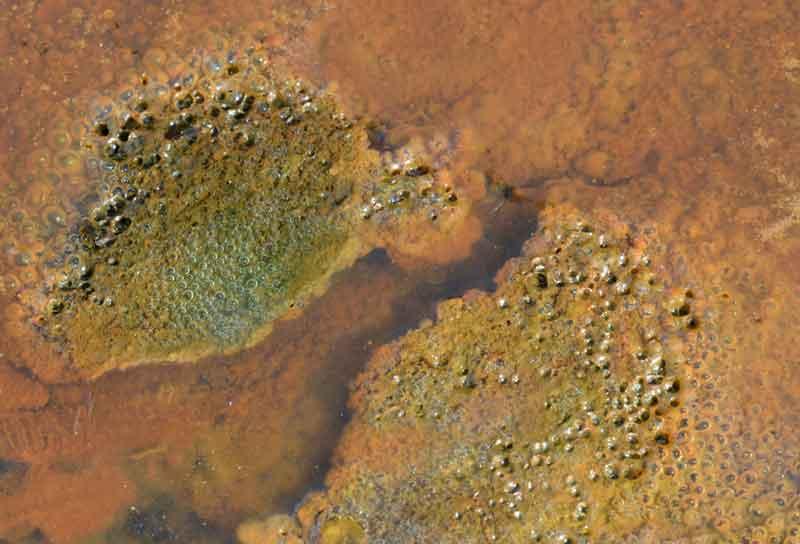
En tout cas, ces concentrations bactériennes représentent des biomasses non négligeables et agissent sur le cycle du fer.
Cela faisait longtemps que j’avais déjà rencontré ces curieux dépôts ou films irisés mais je n’avais pas vraiment jusqu’ici creusé le sujet. Cette chronique a ainsi attiré mon attention de naturaliste plutôt centré sur les « grosses bêtes » vers ces êtres exceptionnels que sont les ferrobactéries. On oublie un peu trop que les bactéries sont des êtres vivants à part entière et qu’elles font partie de la biodiversité globale sans laquelle la vie sur Terre n’aurait pas été possible ; les ferrobactéries ont notamment joué un rôle colossal dans les deux premiers milliards d’années de l’histoire de la Terre en fixant le fer et en le concentrant dans des dépôts ensuite devenus des roches … dont le minerai de fer que nous exploitons. Les bactéries méritent autant notre attention que les oiseaux, les papillons, les fleurs, les champignons, … même si, j’en conviens, entrer en contact avec elles n’est pas des plus faciles. Mais justement les ferrobactéries ont l’avantage d’être « indirectement » bien visibles.
Bibliographie
IRON IN MICROBIAL METABOLISMS Kurt O. Konhauser, Andreas Kappler, and Eric E. Roden ; 2011 ; ElEmEnts, Vol. 7, pp. 89–93
Autotrophic and mixotrophic growth of Gallionella ferruginea L. HALLBECK ; K. PEDERSEN Journal of General Microbiology (1991), 137, 2657-2661.
J’ai aussi utilisé le texte d’un panneau informatif pédagogique installé au bord du lac Chambon (voir illustration) en Auvergne, au milieu d’une aulnaie marécageuse où suintent des sources ferrugineuses. Comme il a été rédigé par des universitaires, j’ai considéré qu’il était scientifiquement fiable.