Sur les ailes des chauves-souris
27/04/2020. Si les chauves-souris ont engendré tant de croyances, souvent à leurs dépens, cela tient très fortement à leurs mœurs nocturnes pour les espèces tempérées au moins et aussi à leur aspect tellement différent des autres mammifères. Le plus souvent, on ne connaît d’elles qu’on vol rapide, insaisissable dans la pénombre. Donc, si tout le monde sait qu’elles volent, très peu savent comment sont faites leurs ailes. Comment s’en servent-elles et quel est leur plan d’organisation générale ? Nous nous appuierons sur notre propre squelette pour mieux comprendre le leur car, en dépit de nos différences majeures, nous sommes quand même des « frères mammifères » ; nous comparerons aussi avec les ailes des oiseaux l’autre groupe majeur de vertébrés actuels capables de vol battu, pour mieux saisir l’extrême unicité des ailes des chauves-souris.
NB : toutes les illustrations ci-dessous libellées MHNB proviennent du Muséum d’Histoire Naturelle de Bourges avec de remarquables présentations sur les chauves-souris.
Patagium
La surface portante de l’aile des chauves-souris est assurée par une membrane de peau fine et souple, un patagium (terme latin signifiant bande ou frange). Cette structure n’a rien d’exclusif aux chiroptères puisqu’on la retrouve chez les oiseaux (mais elle est recouverte de plumes) et chez divers animaux « volants » capables de planer grâce à un repli de peau étendu entre les membres comme chez les écureuils volants au sens large, les galéopithèques (animaux proches des primates) et même chez des lézards ou grenouilles dites « volantes ».

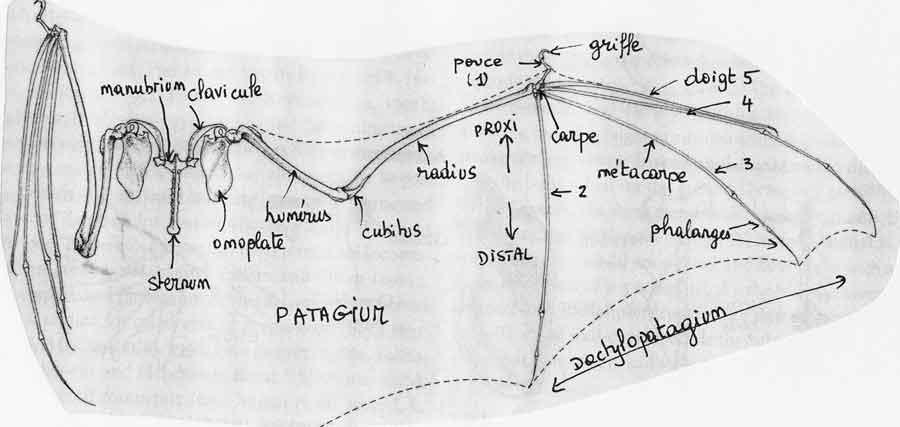
Ce patagium s’étend entre les cinq doigts de la main étendus (le dactylopatagium ou « aile-main »), se prolonge le long du bras et avant-bras (le plagiopatagium ou « aile-bras ») et englobe chez la plupart des espèces les membres postérieurs et la queue (l’uropatagium). Non seulement il procure la surface d’appui de l’aile mais il peut aussi servir à d’autres fonctions complémentaires : envelopper l’animal en hibernation suspendu la tête en bas, retenir le bébé au moment de l’accouchement dans la même position et chez certaines espèces inféodées aux milieux aquatiques servir d’épuisette (l’uropatagium) en passant au ras de l’eau pour cueillir des petits poissons ou des insectes ; c’est le cas par exemple du murin de Daubenton, une espèce répandue en France qui « gaffe » ses proies en surface avec ses pieds et sa membrane alaire !
Ce patagium possède un fin réseau de muscles et de vaisseaux sanguins. L’étendue de cette membrane complique la circulation du sang indispensable sur l’ensemble de la surface. Un système de sphincters musculaires autour des artérioles et veinules permet de pousser le sang plus en avant à la manière d’autant de « mini-cœurs » qui se contractent jusqu’à vint fois par minute ; ainsi le sang réussit à irriguer la membrane jusqu’au bout des doigts !
« Epaule et bras »
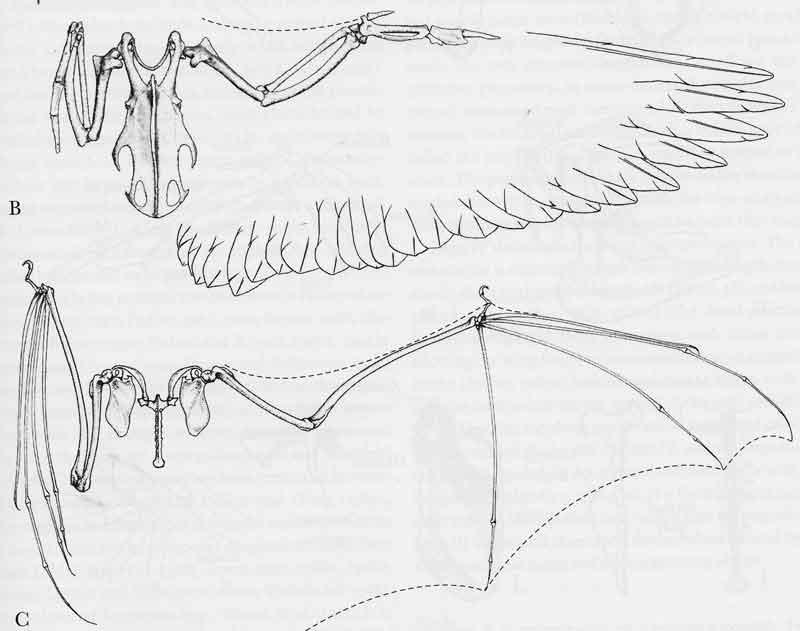
Les ailes des chauves-souris, comme celles des oiseaux, sont en fait des membres antérieurs transformés et leur mobilité se joue au niveau de la ceinture scapulaire (scapula = omoplate), ce que nous appelons en langage courant « l’épaule ». Cette ceinture se raccorde au sternum sur lequel vient s’articuler aussi la cage thoracique. Chez les chauves-souris, il a une forme de T très prononcé avec la partie supérieure, le manubrium (étymologiquement le manche) formant deux bras qui vont s’articuler avec les clavicules relativement massives et courbées. Chaque clavicule vient à son tour s’articuler avec la tête supérieure d’une omoplate. Celles-ci, assez grandes, rectangulaires et ovales s’appuient sur le dos en parallèle de la colonne vertébrale.
Chez les oiseaux, pour comparaison, cette ceinture est radicalement différente avec notamment sur le sternum, une lame osseuse très développée qui se projette en avant, le bréchet, des clavicules soudées en une fourchette et des omoplates réduites complétées par un os long, le coracoïde.
On voit que par contre chez la chauve-souris, nous ne sommes pas trop dépaysés par rapport à nous, c’est-à-dire que le plan d’ensemble de cette ceinture reste assez proche de celui des autres mammifères non-volants. De la même manière, les os du bras et l’avant-bras se rapprochent nettement de ceux de la majorité des mammifères. L’os du bras, l’humérus, articulé avec l’omoplate (qui inclut le coracoïde) et avec les os de l’avant-bras, reste relativement droit. L’avant-bras se compose de deux os comme nous mais le radius domine très fortement au détriment du cubitus très fortement réduit : il ne mesure que ¼ à ¾ de l’humérus et ne s’articule plus qu’avec l’humérus. Si on rapporte leur longueur au poids du corps, ces os ne sont pas plus allongés qu’ils ne le sont chez certains primates aux « bras » développés pour les assister dans leurs déplacements comme chez les gibbons ou les grands singes qui s’appuient sur les phalanges retournées en marche quadrupède.
Ce n’est donc pas cette partie du squelette qui a connu de forts remaniements même si elle est un peu différente.
Main géante
En termes de composition en os, la main des chauves-souris reste relativement peu différente de la nôtre par exemple : le carpe composé de petits os (poignet) et cinq doigts dont un pouce formés chacun de métacarpes (les os de la paume chez nous) et de phalanges (les os des doigts). Bien d’autres mammifères ont des « mains » infiniment plus transformés à ce niveau avec souvent une forte réduction du nombre de doigts. Les os du carpe, disposés sur deux rangs, se soudent plus ou moins entre eux et leur degré de fusion constitue souvent un critère pour déterminer l’âge d’un individu. Par contre, une différence spectaculaire s’affiche clairement quant à l’élongation relative de certains de ces éléments : les métacarpes et les phalanges. En effet, hormis le pouce qui reste petit, les quatre autres doigts deviennent démesurés et ce sont eux qui sous-tendent le patagium en étant capables de se déployer en éventail presque à 180°, le doigt n° 5 formant le bord avant de l’aile. Ils fonctionnent indépendamment les uns des autres et contrôlent donc l’étalement de l’aile de manière très subtile. Le pouce porte une griffe terminale tandis que les autres doigts en sont dépourvus sauf chez certaines grandes espèces frugivores où le doigt n° 2 en conserve une aussi ; chez ces espèces, ces doigts servent à manipuler la nourriture, notamment avec le pouce chez les roussettes.
Contrairement à ceux des oiseaux, aucun des os de l’aile n’est pneumatisé, i.e. avec des cavités internes remplies d’air qui participent à l’allègement du squelette ; la moelle peut être très réduite pour les os des doigts. Et pourtant les chauves-souris se trouvent soumises aux mêmes contraintes physiques que les autres animaux volants à vol battu : la nécessité d’alléger au maximum « la voilure » qu’ils doivent déplacer dans l’air pour avancer. Quel est alors leur secret de fabrication ?
Gradient
Avant de découvrir la particularité de certains de ces os, on notera qu’une réponse à ces contraintes se manifeste au niveau de la taille de ces animaux : la majorité des espèces sont petites à très petites avec les plus grandes espèces qui ne dépassent pas le kilogramme en poids (roussettes) et une envergure d’un peu plus d’un mètre. Pas d’équivalent des cygnes, des grues, des outardes, … chez les chauves-souris ! Et pourtant, elles se montrent d’excellentes voilières, capables de voler sur de longues distances avec certaines espèces entreprenant des migrations sur plusieurs milliers de kilomètres. Elles réussissent à gérer une dépense énergétique basse par rapport à la distance parcourue.
Alors, quelle particularité des os de l’aile autorise de telles performances ? On constate que les os des doigts présente une certaine souplesse, sans la rigidité classique et ce d’autant plus qu’on s’éloigne du poignet. Or, en aérodynamique, on sait qu’une aile à pointe rigide génère des turbulences et des poussées parasites qui diminuent en plus la faculté de contrôler le vol. Les os de la main (métacarpes et phalanges) flexibles autorisent donc des déformations et des cambrures permettant de mieux gérer les flux d’air autour de l’aile tout en diminuant la dépense énergétique.
Mais comment ces os peuvent-ils être « flexibles », qualité antinomique avec la nature osseuse ? Des observations très fines réalisées sur au moins deux espèces différentes démontrent que les phalanges distales (les plus éloignées du poignet) présentent un gradient de calcification dans le même sens : la moitié proximale (la plus proche du poignet) étant assez calcifiée alors que la moitié distale ne l’est presque pas. Ainsi, ces os gagnent en souplesse tout en s’allégeant structurellement. Contrairement à ce qu’on pourrait penser, une aile au squelette plutôt souple s’avère plus résistante à la cassure et moins fragile. D’ailleurs les mâles des chauves-souris s’affrontent régulièrement à coups d’ailes !
Par ailleurs, on pensait que les chauves-souris ne cessaient de battre des ailes en vol ce qui augmente évidemment le coût énergétique. Or, des observations en laboratoire sur la pipistrelle commune montrent qu’elle intercale de brefs glissades (qui durent 1 à 3/10èmes de secondes) avec les battements d’ailes, une manière d’économiser de l’énergie ; sur un épisode de vol, les pipistrelles passeraient 13,5% du temps en glissades passives. Au cours de ces très brefs planés, la pipistrelle plonge ce qui lui permet d’accélérer.
Capteurs
On reste médusé par la manoeuvrabilité du vol des chauves-souris : elles peuvent faire des virages brusques, des crochets, zigzaguer au milieu des feuillages, pratiquer le vol sur place, … Tout ceci suppose un contrôle très strict de toute la surface de l’aile pour adapter sa forme, son extension, sa courbure, … aux situations variées rencontrées. Les chauves-souris disposent pour ce faire de capteurs tactiles ultra-sensibles répartis sur le patagium : de petits poils raides microscopiques en forme de dôme. On a pu démontrer que des neurones du cortex sensitif correspondent avec la sensibilité directionnelle à la stimulation de ces poils par un flux d’air à basse vitesse. Ils semblent surtout réagir au flux renversé qui se produit quand l’écoulement de l’air sur l’aile se sépare (dessus/dessous) et génère des vortex (sortes de tourbillons) déstabilisateurs. Ainsi ces poils agissent comme une batterie de capteurs capables de réguler la vitesse de vol et les conditions d’écoulement de l’air. En laboratoire, si on épile le patagium, le comportement en vol se trouve altéré notamment dans l’évitement des obstacles (alors que l’écholocation fonctionne toujours) : les chauves-souris ainsi rasées tournent moins bien et volent trop vite. L’existence de ces poils est connue depuis plus d’un siècle amis on ignorait jusqu’ici leur rôle ; on avait cru un temps que c’était grâce à eux que les chauves-souris « voyaient » dans le noir ! On connaît des récepteurs équivalents vibrotactiles à la base des plumes des oiseaux.
Décidément, on a bien du mal, entre l’écholocation et ces récepteurs, à imaginer ce qui se doit se passer « dans la tête » d’une chauve-souris en vol !
Aux origines du vol

Evidemment, la question des origines du vol chez les chauves-souris taraude les scientifiques d’autant qu’on ne dispose de quasiment aucun fossile permettant d’élaborer des hypothèses directes. Comment un groupe aussi spécialisé avec un vol battu aussi élaboré et perfectionné a t’il pu émerger il y a environ 6O Ma : à partir de quelle lignée et dans quel contexte écologique ? On notera au préalable que, d’un certain point de vue, les chauves-souris ont fait mieux que les oiseaux en devenant quasiment entièrement « aériennes » et n’utilisant plus leurs membres postérieurs que pour s’accrocher la tête en bas (sauf quelques espèces capables de marcher au sol) ; même les martinets ou les engoulevents (voir la chronique sur ces oiseaux) aux remarquables performances aériennes reviennent « à terre » pour se reproduire ; les chauves-souris accouchent suspendues en l’air !
On a longtemps pensé que les chauves-souris provenaient d’une lignée dans laquelle s’était développé la pratique du vol plané en utilisant un patagium de peau étalé entre les deux paires de membres. La ressemblance avec des animaux étranges, les galéopithèques, avait d’ailleurs conduit à bâtir l’hypothèse des « primates volants » pour une partie des chauves-souris (voir la chronique sur l’histoire des chauves-souris). Fait troublant, ces animaux partagent en commun une innervation particulière du bord d’attaque du patagium que l’on considérait comme un héritage d’un ancêtre commun ; mais, las, on a retrouvé ce dispositif chez des écureuils volants ! De plus, dans la grande lignée mammalienne des Laurasiathères (voir la chronique sur l’histoire du groupe), où s’insèrent les chiroptères, on ne trouve aucun genre d’animal pratiquant le vol glissé plané ! Donc, les chauves-souris ne sont pas issues d’une évolution progressive à partir d’animaux à vol plané.
Bibliographie
Les chauves-souris de France, Belgique, Luxembourg et Suisse. L. Arthur ; M. Lemaire. Ed. Biotope ; 2009
Skeletal adaptations for flight. Ch. 16. S. M. Gatesy ; K. M. Middleton. Pp 269- 283 in Fins into limbs. Evolution, development and Transformation. Ed. by B. K. Hall The University of Chicago Press. 2007
Biomechanics of the Bat Limb Skeleton: Scaling, Material Properties and Mechanics Sharon M. Swartz, Kevin M. Middleton Cells Tissues Organs 2008;187:59–84
INTERMITTENT GLIDING FLIGHT IN THE PIPISTRELLEBAT (PIPISTRELLUS PIPISTRELLUS) (CHIROPTERA: VESPERTILIONIDAE). ADRIAN L. R. THOMAS et al. J. exp. Biol. 149, 407-416 (1990)
Bat wing sensors support flight control. Susanne Sterbing-D’Angelo et al. PNAS 2011 vol. 108 no. 27 11291–11296