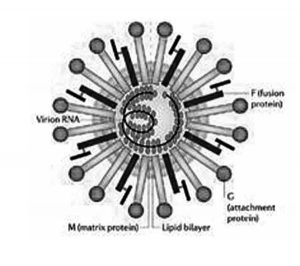
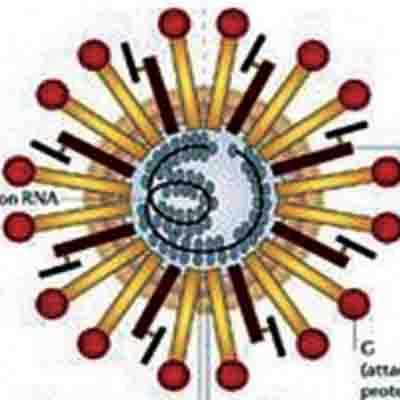
Virus NIPAH, roussettes, palmiers et Bengalis
Henipavirus
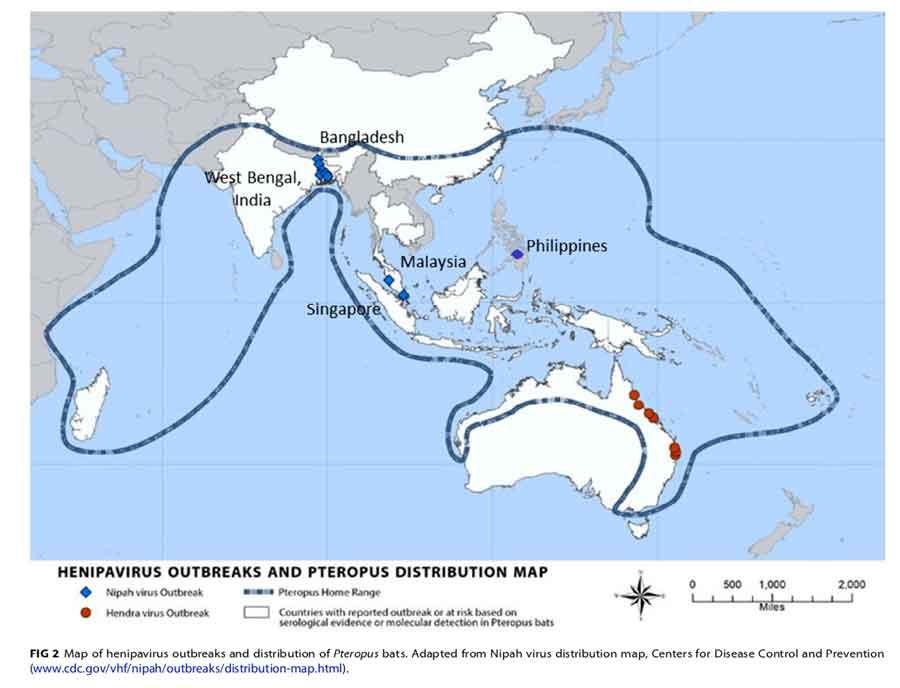
Ce titre pourrait être celui d’une fable mais, plus prosaïquement, il s’agit des quatre acteurs centraux d’un grave problème sanitaire, une zoonose virale, i.e. une maladie virale transmise des animaux aux hommes, qui sévit depuis deux décennies au Bengladesh et déborde en Inde au Kerala. Cette maladie se manifeste par un syndrome de type encéphalite aigüe et se montre particulièrement létale avec des taux de mortalité atteignant parfois les 100% ; par contre, pour l’instant, elle reste assez peu transmissible d’homme à homme et ses épidémies sont localisées et saisonnières. Si on a très vite identifié le réservoir de ce virus NIPAH, la source initiale, de grandes chauves-souris frugivores ou roussettes, il aura fallu plusieurs années d’investigations dignes d’une enquête policière pour comprendre les conditions de passage des roussettes aux hommes et le « coupable » s’est avéré être un palmier, ou plutôt un usage humain très particulier de ce palmier.
NIPAH
Le virus NIPAH n’est pas un coronavirus : il appartient au groupe des paramyxovirus, eux aussi des virus à ARN, qui étaient traditionnellement considérés pour avoir une gamme d’hôtes très limitée et être très peu transmissibles, générant des épidémies peu dangereuses. Ce point de vue a commencé à changer en 1994 avec l’émergence en Australie d’une épidémie qui provoqua la mort de 7 personnes. Le virus responsable, baptisé Hendra (HeV) se transmettait de chevaux malades aux hommes ; on démontra aussi que le vecteur initial de transmission aux chevaux était deux espèces de grandes chauves-souris frugivores locales, des roussettes, via les fruits entamés qu’elles laissent tomber au sol. Ce virus s’avéra alors être un paramyxovirus mais d’un genre nouveau inconnu jusqu’alors : Henipavirus.
Puis fin 1998/début 1999, une épidémie d’encéphalite frappe la Malaisie : la transmission se fait par les porcs d’élevages auprès des gens qui s’en occupent ou dans les abattoirs (ce qui explique un autre foyer apparu à Singapour) ; la mortalité est forte (40%) et plus de 100 personnes en meurent. En 1999, on identifie le virus responsable comme étant un très proche parent du virus Hendra mais différent (80% de ressemblances génétiques) ; on le baptise NIPAH (NiV), du nom d’un village local malais et il constitue le second Henipavirusdésormais connu. Là encore, le vecteur initial s’avère être plusieurs espèces de roussettes frugivores qui séjournent dans les arbres au-dessus des élevages de porcs industriels.
Enfin, à partir de 2001, et pratiquement tous les ans, vont se succéder au Bengladesh des épidémies localisées d’une forme d’encéphalite du même type, très létale (de 70 à 100% de mortalité), et qui se transmet plus facilement d’homme à homme. Le virus est identifié en 2003 : il s’agit d’une souche de virus NIPAH légèrement différente de celle observée en Malaisie (une dizaine de nucléotides en plus), peut-être une « espèce » différente, baptisée NiV-BD (et NiV-MY pour la souche malaise). Très vite, on se rend compte que le scénario est bien différent puisque cette fois les porcs ne sont pas impliqués dans la transmission. Nous allons maintenant nous attarder sur cette épidémie bengalie.
Roussettes
Le vecteur original fut très vite identifié par analogie avec l’épisode malais car en Inde et au Bengladesh, on ne trouve qu’une seule espèce de roussette : la roussette géante d’Inde (Pteropus medius), l’une des plus grandes espèces au monde avec une envergure de 1,50m. On savait que ces chauves-souris (et bien d’autres genres) hébergent de nombreux virus avec lesquels elles ont coévolué depuis très longtemps (voir la chronique sur les Trésors cachés des chauves-souris). Les roussettes infectées ne présentent pas de signes de maladie et, a minima, tolèrent très bien le virus. Par contre, via leur salive, leur urine (et peut-être leurs excréments), elles répandent le virus dans leur environnement, ouvrant la porte à un éventuel « débordement » vers les humains, notamment en passant par des hôtes intermédiaires comme les porcs en Malaisie ou les chevaux en Australie.
Au Bengladesh, cette espèce est effectivement largement répandue dans tout le pays. Ces animaux nocturnes (mais qui n’utilisent pas l’écholocation pour se déplacer : voir la chronique), se nourrissent presque exclusivement de fruits mûrs (bananes, mangues, dattes, …) et de nectar. Le jour, elles se réunissent en gros dortoirs dans la cime de grands arbres avec une préférence pour la proximité de plans d’eau, d’habitat humain (notamment près des temples) et de terres agricoles avec des arbres fruitiers. Quand elles se nourrissent, elles laissent souvent tomber au sol des fruits entamés qui portent donc des traces de leur salive.
Plusieurs types de contacts classiques peuvent expliquer les transmissions de virus des roussettes vers les humains (ou vers les hôtes intermédiaires) : chasser directement ces animaux et consommer leur chair (une roussette géante pèse jusqu’à 1,6 kg !) ; vivre ou avoir des activités sous des sites servant de dortoirs, lesquels sont occupés toute l’année et parfois sur des dizaines d’années ; consommer des fruits tombés au sol et préalablement manipulés ou entamés par ces animaux. Le dernier cas a invoqué en Malaisie avec les élevages de porcs sous des arbres fréquentés par des roussettes.
Suspect en vue
Très vite, l’hypothèse des porcs comme hôtes intermédiaires a été écartée car les zones affectées n’avaient pas d’élevages de ces animaux. On s’est donc orienté vers une transmission « directe » des roussettes aux humains. Dès les premières épidémies, on nota leur saisonnalité marquée pendant l’hiver austral entre novembre et mars alors que les roussettes sont présentes et actives toute l’année ce qui exclut la seconde voie évoquée ci-dessus ; par ailleurs, au Bengladesh, ces animaux ne semblent pas consommés par les populations locales ce qui exclut la première ; enfin, les principaux arbres à fruits sont des palmiers dont les fruits tombés au sol ne sont guère consommés, écartant aussi la troisième piste ! Alors, quelle voie « nouvelle » empruntait ce virus ?
La saison hivernale coïncide avec une pratique culturelle très enracinée au Bengladesh : la récolte de la sève des palmiers cultivés, consommée soit fraîche, soit après fermentation ce qui la transforme en boisson alcoolisée (vin de palme ou rati). Les collecteurs appelés localement gacchis grimpent pieds nus au sommet des grands palmiers, une corde autour de la ceinture pour se sécuriser. Avec un couteau ou une faucille, ils découpent le soir dans l’écorce proche du sommet une fente en forme de V ; dans la pointe du V, ils insèrent un tube creux de bambou et placent juste en dessous un pot en terre cuite accroché qui recueille la sève suintant de la blessure. La récolte se fait très tôt le lendemain matin et la sève fraîche est consommée dans les heures qui suivent ou bien mise à fermenter.

Or, on sait que les roussettes apprécient beaucoup ces écoulements de sève et viennent régulièrement lécher les zones coupées, déposant à cette occasion de la salive et/ou de l’urine dans la sève qui s’écoule et est collectée plus bas. Les gacchis le savent très bien et vérifient l’état de la sève recueillie en la goûtant pour vérifier son bon état : sinon, la sève se trouble et devient malodorante du fait de cette contamination. Donc, tout converge vers cette quatrième voie : la consommation de la sève des palmiers.
Enquêtes
Au cours d’une étude, des chercheurs ont visité 60 villages entre 2011 et 2013 où des épidémies de NIPAH aveint sévi et 147 villages non touchés de manière à pouvoir comparer un certain nombre de critères possibles de risque d’infection : taille des populations de roussettes ; taille des villages ; nombre de palmiers exploités pour la sève et fréquence du comportement de consommation de cette sève. La comparaison montre que les deux séries de villages ne diffèrent pas pour les trois premiers critères mais, par contre, les villages touchés avaient une plus forte proportion de foyers humains où au moins une personne consommait de la sève. C’est donc bien la conjonction de la consommation humaine de sève fraîche et sa contamination par l’urine ou la salive des roussettes qui permet la propagation du virus. Pour autant, dans les villages contrôles non touchés, on note bien aussi une certaine consommation de sève mais avec une fréquence moindre.
Une autre enquête épidémiologique cette fois conduite entre 2010 et 2014 dans les hôpitaux du pays a permis d’identifier 18 clusters (terme brusquement devenu familier !) d’infection NiV. Trois d’entre eux ont été analysés en détail avec 14 patients atteints dont 8 sont décédés. 8 d’entre eux avaient consommé du tari, de la sève fermentée de manière régulière avant de tomber malade et 6 autres avaient prodigué des soins à des personnes malades du NiV (transmission d’homme à homme). Donc, même fermentée après sa collecte, la sève conserve son potentiel d’infection si elle était contaminée par les roussettes.
Pour confirmer le rôle des roussettes, une étude avec la pose d’une caméra à infra-rouge sur un palmier incisé : sur vingt nuits de suivi photographique, 14 ont vu des visites de roussette (132), la grande majorité venant lécher l’incision en V et quelques unes plus bas le long de l’écoulement vers le pot. Donc, les visites des roussettes sont relativement régulières et bien susceptibles d’aboutir à une contamination de la sève. Ainsi, la prévention de cette maladie doit se concentrer sur la collecte de la sève en amont de la consommation, de manière à prévenir la contamination de la sève récoltée.
Prévention
Il était impensable d’interdire la consommation de sève fraiche ou fermentée : le Bengladesh a une population de 160 millions d’habitants et, en 2015, 70% d’entre eux vivaient dans des zones rurales où la sève est récoltée. Plus de 30% des foyers ruraux avaient au moins un consommateur régulier de ce breuvage, soit des millions de personnes concernées ! Par ailleurs, la roussette géante est une espèce ubiquiste très répandue partout : donc impossible de régionaliser des mesures d’interdiction non plus.
Il a donc fallu s’appuyer avant tout sur les pratiques culturelles pour mettre au point un programme de prévention susceptible de fonctionner efficacement. Les Gacchis (les collecteurs) se préoccupaient depuis longtemps des visites des roussettes dans la mesure où elles concurrencent la production et déposent des excréments qui rendent la sève inutilisable (l’urine et la salive ne se voient pas !). Localement, ils avaient déjà mis en place des techniques pour limiter l’accès des roussettes aux flux de sève mais sans grande motivation faute de temps et d’argent. Ces techniques consistent à poser autour du tronc, par dessus l’incision et la zone découlement des « jupes » végétales, soit en bambous, ou avec d’autres matériaux locaux comme du jute. Les chercheurs ont donc d’abord évalué l’impact réel de ces techniques sur l’accès des roussettes en utilisant les mêmes caméras infra-rouge devant ces dispositifs. Quelque soit le matériau utilisé, les jupes végétales semblent bien limiter sérieusement l’accès des roussettes sans que cela impacte la qualité ni la quantité de sève recueillie. Leur coût reste très limité mais il subsiste l’écueil du temps passé à les préparer et à les installer et déplacer à chaque incision : la saison de récolte de sève est intense et les gacchis doivent escalader chaque matin des dizaines d’arbres !

Une autre pratique relatée par les gacchis consiste à ajouter du carbonate de calcium sur la zone incisée ou dans les pots pour clarifier la sève et lui donner une meilleure qualité : or, ils ont observé que les roussettes évitent les arbres ainsi traités à cause du goût fort de ce produit.
En s’appuyant sur ces deux dispositifs pré-inventés en quelque sorte et familiers des populations locales, on peut espérer les convaincre via des campagnes incitatives à les généraliser et ainsi sérieusement réduire ce risque d’infection NiV.
Cet exemple nous montre que les solutions de prévention ne peuvent se faire d’une part sans des études scientifiques approfondies pour identifier clairement les voies de contamination et qu’elles demandent du temps et d’autre part sans s’appuyer sur la collaboration active et culturelle des populations locales, riches de savoirs ancestraux pouvant paraître anecdotiques. Il reste aussi à surveiller sérieusement l’évolution de ce virus car, en cas de mutation lui conférant une plus grande transmissibilité d’homme à homme, il deviendrait un danger considérable vu sa létalité !
Bibliographie
Nipah virus infection. Ang BSP, Lim TCC, Wang L. 2018. J Clin Microbiol 56:e01875-17.
A Randomized Controlled Trial of Interventions to Impede Date Palm Sap Contamination by Bats to Prevent Nipah Virus Transmission in Bangladesh. Khan SU, Gurley ES, Hossain MJ, Nahar N, Sharker MAY, et al. (2012) PLoS ONE 7(8): e42689.
Convergence of Humans, Bats, Trees, and Culture in Nipah Virus Transmission, Bangladesh. Emily S. Gurley et al. Emerging Infectious Diseases Vol. 23, No. 9, 2017
Nipah Virus Transmission with Drinking Traditional from Bats to Humans Associated Liquor Made from Date Palm Sap, Bangladesh, 2011–2014 M. Saiful Islam et al. Emerging Infectious Diseases Vol. 22, No. 4, 2016
Piloting the use of indigenous methods to prevent Nipah virus infection by interrupting bats’ access to date palm sap in Bangladesh. N. Nahar et al. Health Promotion International, Vol. 28 No. 3 2012