Épeire diadème : l’effondrement d’une espèce commune
Araneus diadematus
31/10/2022 Dans la chronique Crash silencieux en plein vol, nous avions présenté les résultats d’une étude menée en Allemagne en 2017 dans 60 zones naturelles protégées : elle démontrait une chute de 75% de la biomasse des insectes volants en trois décades ; d’autres études du même type ont suivi et les résultats convergent vers une fonte massive des populations d’insectes à une échelle globale en Europe de l’Ouest. Ce déclin alarmant implique des conséquences écologiques en cascade quand on sait que les insectes forment la base de la plupart des réseaux et chaînes alimentaires : un monde considérablement appauvri en insectes signifie autant de prédateurs insectivores (oiseaux, batraciens, lézards, petits mammifères, autres insectes prédateurs et araignées) privé de nourriture et condamnés à leur tour à connaître un fort déclin. Ceci a été déjà démontré sur les oiseaux insectivores en Suisse.
Un groupe d’araignées se trouve tout particulièrement concerné : celles qui tissent des toiles pour capturer des proies qu’elles interceptent en plein vol et tout particulièrement les orbitèles, l’ensemble des espèces d’araignées qui tissent des toiles régulières circulaires. Une équipe de chercheurs suisses vient d’explorer l’état des populations de ces araignées en première ligne face au déclin des insectes en prenant comme espèce modèle, l’épeire diadème, une espèce réputée jusqu’alors très commune partout.
Diadème en croix
Effectivement, l’épeire diadème est une des araignées les plus connues parmi celles vivant hors des intérieurs des maisons. Sa famille de rattachement, les aranéides, renferme de nombreuses espèces dont certaines de grande taille et très colorées comme l’argiope frelon (voir la chronique). Son identification ne pose pas de problème grâce au dessin typique qu’elle porte sur le dos de son gros abdomen : une croix blanche bien marquée, accompagnée dans la partie postérieure de dessins blancs, sur un fond variable allant du brun foncé au brun orangé clair. L’abdomen peut être presque rond chez les femelles prêtes à pondre ou venant de faire un gros repas à ovale triangulaire mais on notera que la plus grande largeur se trouve toujours dans le tiers antérieur ; les pattes portent des anneaux colorés alternativement clairs et sombres. Si la taille des femelles se situe entre 12 et 17mm, celle des mâles se situe en dessous de 10mm.
Un autre trait typique de cette espèce concerne sa position sur sa toile : elle se tient le plus souvent en plein centre de celle-ci, la tête en bas, sauf si on la dérange. La toile est tissée entre des tiges de hautes herbes ou de buissons bas et se compose d’une trentaine de rayons avec un centre (« moyeu ») plus serré ; elle est organisée en plusieurs secteurs de structure différente dont un fait de soie collante pour la capture.
Cette espèce se montre surtout en été et les accouplements ont lieu en août et la ponte en automne dans un cocon de soie jaune. Les jeunes y éclosent en hiver et le quittent au printemps. Ils n’atteignent la maturité sexuelle qu’au bout de un à deux ans.
L’épeire diadème se comporte en espèce généraliste fréquentant toutes sortes de milieux herbacés avec une certaine préférence pour ceux incluant des buissons bas plus propices pour l’installation des toiles. Ses habitats typiques sont les jardins, les parcs, les cimetières, les haies et bordures herbeuses des cultures, les lisières forestières et les larges chemins forestiers. Dans toute la littérature de vulgarisation et la majorité des sites consacrés à la faune ordinaire on la présente comme une espèce banale, commune et répandue. Si cela a été effectivement vrai il y a encore quelques décades, est-ce toujours vraiment le cas ?
Recensements
Pour pouvoir évaluer l’état actuel des populations, il faut effectuer des recensements pour en tirer des densités servant de point de comparaison avec des données plus anciennes. En Suisse centrale où l’étude a été menée, les chercheurs utilisent la méthode des comptages de toiles occupées, bien adaptée à cette espèce orbitèle à toile assez grande. Sur vingt sites sélectionnés de manière à couvrir les différents habitats de l’espèce, ils parcourent des transects en suivant des chemins traversant ou suivant qui un parc, qui une lisière, … sur des longueurs variant de 1km à 500 ou 200m selon les milieux et leur étendue. La technique consiste à marcher lentement le long du chemin et de chercher intensivement à vue dans la végétation des toiles en se focalisant sur une bande de 1m en bordure du chemin et jusqu’à 2m de hauteur ; les visites se font l’après-midi, au pic d’activité de ces araignées, par un temps sans pluie en août septembre. Comme l’épeire diadème bâtit ses toiles entre 0,50 et 2m il ne sert à rien de chercher plus haut ce qui permet de concentrer l’activité de recherche. Seules les toiles occupées par des femelles (les mâles vagabondent) en place sont comptées ; la femelle placée au centre de la toile (voir ci-dessus) avec sa croix blanche se repère facilement avec un peu d’attention. Il se peut que des toiles vides soient en fait occupées mais que la femelle est cachée en bordure : on ne peut les prendre en compte faute d’être sûr qu’il s’agit bien d’une toile de cette espèce car d’autres orbitèles tissent des toiles comparables. On ne prend pas en compte non plus les immatures (voir paragraphe ci-dessus) car ils bâtissent des toiles plus petites et donc moins visibles : leur comptage serait donc sujet à une marge d’erreur importante.
Pour s’assurer de la validité des comptages (donnent-ils une densité suffisamment proche de la réalité), les chercheurs ont de plus parcouru intensément plusieurs jours de suite deux jardins conduits en bio.
Le grand intérêt de cette étude est d’être conduite par des chercheurs qui étudient cette espèce dans ce secteur de la suisse depuis des décennies ; ils disposent donc de données datant des années 1970 et obtenues par la même méthode de recensement ce qui rend les comparaisons légitimes. Ils ont aussi pris en compte des données publiées par d’autres chercheurs. On va donc pouvoir comparer à 50-60 ans d’écart l’évolution des populations de cette espèce.
Sidération
Les résultats obtenus laissent pantois et font froid dans le dos : dans deux-tiers des 20 sites recensés, aucune femelle n’a pu être trouvée ce qui donne une densité générale de toiles au m2 proche de … 0 (entre 0 et 0,002) bien loin de la moyenne des données passées autour de 0,067. Autrement dit, la densité des toiles d’épeire diadème est 140 fois moindre en 2019 par rapport aux données collectées dans les dernières décades du 20ème siècle. On peut donc là aussi comme pour les insectes volants (voir la chronique) parler de crash silencieux au point de se demander si on ne frôle pas l’extinction. Avant d’analyser les causes possibles de cet effondrement sidérant de la part d’une espèce connue comme commune, il faut d’abord explorer si l’étude ne souffre pas de biais procéduraux.
On sait qu’en général les densités obtenues par ce mode de comptage donnent des densités inférieures à 100% des populations présentes effectivement : on se situe plutôt entre 66 et 88%. Ceci s’explique par le comportement des épeires diadèmes : elles fabriquent leurs toiles durant la nuit et les refabriquent chaque matin tôt pour conserver leur efficacité ; mais quand elles ont beaucoup mangé sur des sites de chasse favorables, elles peuvent ensuite rester un ou plusieurs jours sans retisser leur toile. Oui mais, dans cette étude, les données passées et présentes ont été obtenues par la même méthode et d’autre part comme tout indique (voir ci-dessous) que les araignées souffrent d’un manque de proies, elles devraient au contraire actuellement retisser plus leurs toiles. Donc la probabilité qu’on ait sous-estimé les densités semble très peu probable.
Autre biais possible : en 2019, les chercheurs n’ont pas réussi à trouver de terrains vagues péri-urbains du type de ceux inventoriés dans les années 70 : tous ces milieux ont été détruits par l’urbanisation dans ce secteur de Suisse centrale soumis à une très forte pression humaine. Mais ces milieux herbacés étaient globalement peu favorables à l’épeire diadème car dépourvus des buissons bas dont elle a besoin pour ses toiles ; donc, leur absence en 2019 n’a pas du impacter significativement les résultats.
Famine
Plusieurs indices convergents confirment que l’une des causes majeures de ce crash de populations semble bien être l’effondrement des populations de proies potentielles.
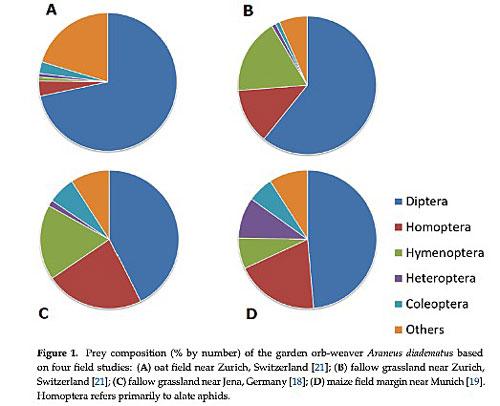
On sait que ces araignées capturent dans leurs toiles divers insectes volants dont des pucerons (individus ailés), des diptères et des hyménoptères. Or, ces deux derniers groupes font partie des plus impactés par le fort déclin détecté en 2017 (voir la chronique). Pendant l’étude de 2019, les chercheurs ont par ailleurs compté le nombre de proies dans les toiles : l’araignée les stocke emballées dans de la soie dans des coins de la toile. Or, le nombre moyen de proies par toile a significativement baissé entre 2019 et les données antérieures du 20ème siècle.
D’autre part, les chercheurs ont noté qu’en 2019 les toiles semblaient plus fragiles (ce sont des experts n’oublions pas) ; or, en élevage expérimental on sait que des araignées privées de nourriture produisent quantitativement moins de soie et tissent des fils plus fins. Ceci pourrait d’ailleurs avoir des impacts sur l’efficacité des toiles quand la proie interceptée se débat.
L’impression globale de rareté des proies sur la zone d’étude a par ailleurs été confirmée par nombre d’autres études en Suisse centrale. Entre autres, on connaît bien le syndrome du pare-chocs : dans les décades passées, les pare-chocs des voitures ayant circulé dans la campagne étaient crépis de cadavres d’insectes entrés en collision versus les pare-chocs désespérément « propres » de nos jours.
D’autres observations passées concernent directement le comportement de chasse des épeires diadèmes : il y a quelques décades on pouvait observer des véritables « massacres d’insectes » sur des toiles d’épeires en des sites favorables avec jusqu’à … 1000 proies/toile/jour, spectacle devenu introuvable de nos jours.

L’équipement du prédateur : paire de chélicères articulés 
Crochets venimeux des chélicères 
4 yeux par côté du céphalothorax
Globalement, ce manque de proies potentielles a forcément impacté la croissance et la reproduction (fabrication des œufs notamment) ce qui en retour a conduit au fort déclin démontré ici.
Une autre preuve indirecte est apportée par une autre araignée, l’épeire des ponts (Larinioides sclopetarius) : cette espèce nocturne vit sur les berges près de l’eau ; or, depuis une décennie au moins, on observe une forte augmentation de ses populations aux abords de zones urbanisées alors que toutes les autres espèces de taille équivalente sont en fort déclin. La raison de ce succès inattendu tient à sa capacité à exploiter les éclairages publics : elle bâtit sa toile sous les lumières des rues bordant un ruisseau ou une rivière ou le long des voies ferrées éclairées. Elle exploite ainsi les insectes semi-aquatiques (phryganes, éphémères, chironomes) attirés en masse par ces éclairages ; à cause de cette ressource élevée artificielle, elle a investi avec succès les zones urbanisées en hautes densités depuis le début du 21ème siècle en suisse et dans d’autres pays d’Europe de l’Ouest. Cet exemple très surprenant illustre bien l’importance de la ressource alimentaire comme prérequis pour maintenir des populations prospères.
Mais d’autres causes touchant directement les araignées peuvent aussi être invoquées.
Pollution chimique
On pense évidemment aux pesticides épandus par l’agriculture intensive ou même en foresterie (lutte contre les chenilles défoliatrices ou les scolytes par épandages aériens), connus pour leurs effets délétères sur les populations d’insectes en général et responsables majeurs du crash démontré en 2017. Plusieurs études pointent des effets variables de ces derniers.
Dans un verger conduit en bio, on a suivi les effets sur les populations d’épeires diadèmes de l’application d’un produit insecticide autorisé en agriculture biologique : le spinosad. Ce produit est en effet un mélange de toxines produites par une bactérie du sol et agit comme un neurotoxique à la manière des sinistres néonicotinoïdes : son origine « naturelle » justifie son emploi en bio. Un jour après l’application, le nombre de toiles a baissé de 28% ; au 14ème jour, 47% par rapport à la densité initiale élevée de 0,2/m2 ; d’autre part, le nombre de toiles anormalement placées augmente de 50% au bout de 3 jours et le nombre de toiles incomplètes de 75% ; on observe aussi une forte réduction du parallélisme des fils des toiles. Donc globalement l’application de ce produit a induit une triple perturbation : mécanique, toxicologique et alimentaire. Ironie de l’histoire : dans les vergers bio, on mise beaucoup sur les araignées pour réguler les populations d’insectes non désirés (pucerons, papillons de nuit, …)
Dans une autre étude, on a testé les effets de 3 substances chimiques utilisées comme insecticides : le thiaméthoxame (néonicotinoïde), l’huile de neem (extraite des graines d’un arbre tropical, le margousier) et la deltaméthrine (pyréthrinoïde). Les deux premiers ne semblent pas avoir d’effets sur la fabrication des toiles et la capture des proies alors que le troisième induit une baisse de la consommation de proies pourtant fournies expérimentalement ad libitum. Or, cette dernière substance est utilisée en épandages aériens contre la chrysomèle du maïs ou dans les opérations de démoustication ; comme elle dérive de substances proches de celles produites par une plante le pyrèthre (astéracée), on tend à minimiser son impact.
Tout ceci démontre que, même si leurs effets peuvent ne pas être prononcés, les pesticides et même certains insecticides dits naturels impactent les araignées directement en plus d’appauvrir considérablement les populations de proies potentielles.
Changement global
Il reste à invoquer les multiples aspects de ce qu’on peut appeler le changement global qui affecte notamment l’usage des terres. Ainsi, dans les milieux forestiers qu’elle fréquentait, plusieurs pratiques « modernes » la défavorisent : nettoyage de la strate arbustive et broyage des lisières, fauchage régulier des allées. L’agriculture intensive uniformise les paysages cultivés en détruisant les haies et en altérant les bandes herbeuses via les pesticides. L’urbanisation galopante grignote de plus en plus de terres : comme indiqué plus haut, les terrains vagues et autres friches herbacées proches des villes ont été engloutis par la bétonisation des espaces. Les jardins hyper entretenus (tontes répétées, élagage des buissons bas) ne peuvent plus servir de refuges. Les auteurs de l’étude citent à cet égard un exemple frappant près de Zurich sur un site entre une autoroute et la berge d’une rivière : en 1970, il était colonisé par de hautes herbes et à l’époque hébergeait des densités pouvant aller jusqu’à 6 toiles/m2 dans des taches favorables. Quarante ans plus tard, cet espace a été converti en aire de repos avec des pelouses tondues à ras : la densité trouvée n’y est plus que de … 0,002 toiles/m2.
Les effets de l’urbanisation ont été testés en suivant un réseau de 63 stations avec des intensités d’urbanisation différentes. On constate que les épeires sont plus petites dans les zones très urbanisées et que la surface des toiles et la taille des fils diminue ce qui confirme l’effet du manque de nourriture. Bien que la fécondité baisse à l’échelle locale avec l’urbanisation, l’abondance reste identique au long des gradients d’urbanisation ce qui montre des capacités d’adaptation comportementales à l’échelle des populations.
Le fait qu’entre les deux études (passé et présent), il n’y ait eu aucun suivi intermédiaire peut conduire à imaginer que les résultats de 2019 soient exceptionnels et s’inscrivent dans la gamme des fluctuations habituelles des populations de l’espèce. Plusieurs indices tendent à démontrer que ce n’est pas le cas. Ce déclin vertigineux jusqu’à moins de 1% des densités initiales sur 40 ans n’a jamais été observé ailleurs sur des périodes courtes. Des données sur d’autres sites dans d’autres pays (Allemagne, Belgique) montrent la même tendance ; en Suisse, en 2017, une opération de recensement de biodiversité a été conduite sur un ensemble de jardins publics près de Bâle couvrant 180 000m2 : en 24 heures, seules 3 épeires diadèmes y furent trouvées alors qu’elle y était réputée commune auparavant. En Belgique, près de Gand, on a mis en évidence des déclins de l’ordre de 10 à 20 fois en dix ans.
Reste l’impact possible du réchauffement climatique en cours et de l’effet de l’îlot de chaleur associé en milieu urbain. Une étude expérimentale montre que l’épeire diadème choisit un gradient de température autour de 22,5°C ce qui en fait a priori une espèce thermophile : d’autre part, cette température correspond aussi au pic d’activité des insectes volants ; elle semble bien adaptée à de fortes fluctuations de températures. Par contre la technique de chasse de l’attente en plein milieu de la toile doit devenir problématique lors des canicules.
Il reste à savoir si ces tendances s’appliquent dans toute l’Europe de l’Ouest mais d’ores et déjà il faudrait peut-être cesser de reconduire dans les textes l’idée que l’épeire diadème est commune et répandue partout ; ceci n’est plus du tout vrai d’ores et déjà en Suisse centrale, en Belgique, en Allemagne, … Se préoccuper des espèces rares protégées comme seule référence par rapport à la protection des sites est un leurre au regard de toutes ces espèces de la biodiversité ordinaire qui disparaissent à une vitesse folle sous nos yeux sans même que nous en ayons conscience. Quand on détruit une friche, il peut n’y avoir aucune espèce rare selon les critères « anciens » mais par contre on détruit un milieu de vie d’espèces dites communes et qui le sont de moins en moins (les espèces rares de demain : absurde). Il est temps de penser la conservation du vivant dans sa globalité en prenant en compte toutes les interdépendances entre espèces, quel que soit leur statut d’abondance avéré ou supposé ; il n’y a pas de hiérarchie entre espèces vivantes quant à savoir si elles méritent ou pas d’être protégées : toutes sont d’importance égale et ont autant de valeur les unes que les autres. Gros changements en vue de logiciel de pensée pour les humains.
Bibliographie
Where Have All the Spiders Gone? Observations of a Dramatic Population Density Decline in the Once Very Abundant Garden Spider, Araneus diadematus (Araneae: Araneidae), in the Swiss Midland Martin Nyffeler Dries Bonte Insects 2020, 11, 248
Spinosad application in an apple orchard affects both the abundance of the spider Araneus diadematus and its web construction behaviour. C. Mazzia et al. Ecotoxicology volume 29, pages389–397 (2020)
Determination of the functional response in the orb-weaving spider Araneus diadematus (Araneae: Araneidae) according to insecticide type. Kieran M. Boyd et al. Ecological entomology. Volume47, Issue5 2022 pp. 791-800
Urbanization-driven changes in web building and body size in an orb web spider Maxime Dahirel et al. J Anim Ecol. 2019;88:79–91.
Thermal preferences of two spider species: an orb-web weaver and a synanthropic funnel-web weaver T. NAPIÓRKOWSKA et al. The European Zoological Journal, 2021, 824–836