A la rencontre des vers de terre ou lombrics
10/02/2024 Ver de terre : quoi de plus banal direz-vous, tout le monde en a déjà vu au moins une fois dans sa vie et sait ce que c’est. En êtes-vous si sûr(e) ? Que sait-on vraiment de ces animaux si répandus et réputés pour leur importance écologique et agronomique ? Pas grand-chose le plus souvent ou, pire, de nombreuses idées reçues ! Il faut dire que leur vie souterraine ne facilite guère leur connaissance.
Aussi, avons-nous choisi de les découvrir de manière approfondie en leur consacrant une série de chroniques. Bien connaître ces êtres exceptionnels est une étape indispensable pour entamer un rapprochement urgent et nouer avec eux une alliance vitale pour notre avenir : ce sont eux qui nous nourrissent vraiment en fait compte-tenu de leur impact considérable sur la vie des sols ! Aussi pour cesser de les malmener, souvent par ignorance ou méconnaissance, y compris dans nos « petits » jardins.
Dans cette première chronique nous allons voir qui ils sont : première étape indispensable pour comprendre ensuite comment ils interagissent avec leur environnement et les autres vivants dont les plantes.
Vers … flous
Commençons par le(s) nom(s) que les Humains ont posé sur eux : ils devraient nous dire un peu de la manière dont les percevons.

« Ver » ne dit pas grand-chose car ce nom s’applique à toutes sortes d’invertébrés qui partagent le fait d’être rampants, allongés, plus ou moins arrondis (en section), sans « pattes » et avec un corps mou plus ou annelé. Avec une définition aussi floue, pas étonnant qu’on ait attribué le qualificatif de ver à toutes sortes d’invertébrés y compris diverses larves d’insectes dépourvues de pattes comme le ver de la cerise (asticot de mouche) mais aussi à d’autres par contre bien dotées de pattes : le ver gris (chenille de noctuelle), le ver à soie (chenille du bombyx du mûrier), le ver blanc (larve de hanneton), …
Bref, un mot presque vide de sens qui traduit simplement l’incapacité à cerner ces animaux autrement qu’en les reléguant dans le groupe fourre-tout des « vers ». D’un point de vue scientifique, ver n’a pas grande signification : il existe de nombreux groupes d’invertébrés d’aspect vermiforme mais sans apparentement direct. Il s’agit simplement d’une convergence de forme. Autrefois, on nommait ainsi « vers » des groupes très différents comme les vers plats (Plathelminthes) : douves, ténias (ver solitaire !), planaires, … Il existe même des mollusques peu connus entièrement vermiformes comme les Solénogastres. Certains groupes de vertébrés apodes ont tout autant un aspect vermiforme : les Cécilies parmi les amphibiens ou les Amphisbènes parmi les squamates (lézards et serpents), …eux aussi vivent dans le sol dans des galeries !
« De terre » apporte un petit plus (on le retrouve dans le nom anglais earthworm) en précisant le milieu de vie. Mais, là encore, terre reste un mot très vague et il vaudrait mieux parler de ver du sol.
Reste lombric qui sonne plus spécifique. Il remonte au 12ème siècle sous la forme lumbris empruntée au latin lumbricus. Rien à voir avec lubricus (glissant) qui a donné lubrique et lubrifier.
Lumbricus au sens propre signifiait « ver intestinal » à partir de lumbus (reins, lombaires). Autrement dit, on retombe en fait sur l’éternel ver fourre-tout ! A noter qu’au 18ème, on l’écrivait lombrique et qu’il existe un verbe (désuet) lombriquer signifiant creuser ou avancer comme un lombric !
Par ailleurs, on trouve régionalement des noms dérivés d’aiche ou éche, nom donné par les pêcheurs aux vers utilisés comme appât (esche) ou encore les vers pour nourrir des oiseaux en cage. Ce mot a donné localement achet (en Saintonge) ou achée dans diverses régions.
On voit donc qu’historiquement, les lombrics n’ont pas tellement suscité d’intérêt (sauf utilitaire) vu le flou général régnant autour de leur dénomination.
Annélides
Scientifiquement, les lombrics se classent dans un groupe : les Annélides, soit les « vers annelés ». Ce nom traduit bien un caractère majeur bien visible : le corps constitué d’une série d’anneaux (métamères) identiques sauf dans la partie antérieure où certains sont transformés et plus spécialisés ; intérieurement, ils sont séparés par des cloisons. Les lombrics en comptent en moyenne entre 60 et 150. Cette division externe se retrouve en interne puisque chaque anneau renferme au moins un élément du système nerveux, un de l’appareil circulatoire, une paire d’organes excréteurs (néphridies). Autrement dit, un corps qui se répète autant de fois (ou presque) qu’il y a d’anneaux !

Annélide Polychète marine 
Annélide Achète : sangsue de rivière 
Annélide Oligochète : Tubifex aquatique
Au sein des Annélides, on distingue trois grands groupes selon la présence ou pas d’excroissances latérales dotées de soies, servant à la locomotion. Ainsi les Annélides Polychètes (nombreuses soies ; chaetos = chevelure), tous marins, possèdent sur chaque segment une paire d’expansions en forme de rames (parapodes) leur permettant de nager ou ramper sur le fond comme chez les néréis. Inversement, le groupe des Sangsues ne possède aucune expansion latérale (Achètes = sans soies latérales).
Les Lombrics se situent dans un troisième groupe un peu intermédiaire : les Oligochètes, i.e. les annélides avec « peu de soies ». A la place des parapodes, ils ont sur chaque anneau quatre paires de soies dures (en chitine) qui servent de points d’appui ou d’accrochage lors des déplacements. Dans ce groupe très diversifié (plus de 10 000 espèces soit la moitié des Annélides), on trouve des formes marines, d’eau douce (comme les tubifex) et des formes terrestres avec les lombriciens au sens large dont la famille des Lumbricidés qui renferme au moins 700 espèces dans le monde. Elle englobe la grande majorité de nos « vers de terre » dont une vingtaine d’espèces sont communes en Europe.
Et la tête ?
La majorité des espèces ont une taille moyenne comprise entre 5 et 15 cm. Elle peut aller jusqu’à 35cm en Europe centrale et 75cm en Europe méridionale. Pour une espèce donnée, on observe de très fortes variations de taille entre individus : les adultes des espèces à grande longévité peuvent être jusqu’à 100 fois plus grands que leurs juvéniles à l’éclosion.
Une question vient inéluctablement, surtout de la part des enfants, face à un lombric qui ne se déplace pas : mais où est l’avant et l’arrière ? C’est sans doute là un des points qui nous déconcertent le plus, nous Humains, habitués à notre modèle mammalien très « céphalisé » !
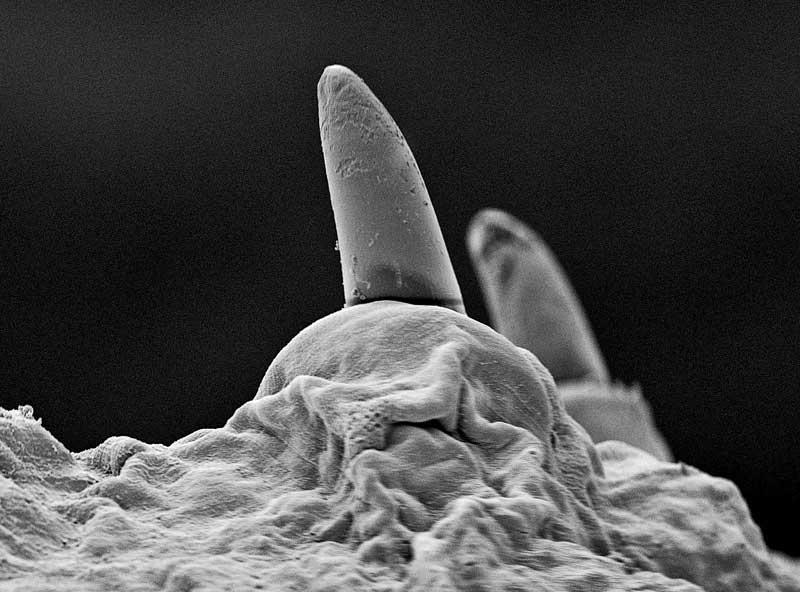
Effectivement, nous avons vu que les anneaux constitutifs étaient plutôt identiques. Pour autant, il y a quand même une certaine différenciation de la partie antérieure, soit une « tête ». Mais, elle ne porte pas d’organes sensoriels visibles : pas d’yeux, pas « d’oreilles », pas de « nez », … Même pas de bouche visible : et pourtant, elle existe bien sur le premier segment (prostomium) mais n’est visible que par en dessous.

Vue de la tête au microscope électronique : la bouche en forme de U au bout du premier segment. Cliché Hannah G Watson, Andrew T Ashchi, Glen S Marrs, Cecil J Saunders C.C. 4.0
L’absence d’yeux n’a rien de surprenant pour des animaux passant toute leur vie ou presque sous terre ou au milieu de débris de la litière. Pour autant, ils portent bien des récepteurs sensibles à la lumière qu’ils fuient (photophobes) : ceux qui viennent en surface pour se nourrir ne le font que la nuit. Ils ont aussi des détecteurs de vibrations sous leur ventre qui leur permettent de repérer des prédateurs en approche comme les taupes.
Le système nerveux montre même une certaine condensation au niveau céphalique avec une paire de ganglions cérébraux en avant de la bouche, rattachée à un collier nerveux qui entoure l’œsophage et se prolonge en une double chaîne nerveuse ventrale jalonnée de petits ganglions (deux par anneau) qui va jusqu’au bout du corps.
Squelette … liquide
Avec les céphalopodes, les lombrics sont parmi les très rares « invertébrés » à posséder un système circulatoire entièrement clos constitué d’un gros vaisseau dorsal et d’un ventral (visibles souvent par transparence) avec des ramifications latérales en réseaux de capillaires. Dans certains anneaux, des vaisseaux élargis jouent le rôle de cœurs contractiles (au moins quatre) qui relancent la circulation d’un « vrai » sang avec des pigments transporteurs d’oxygène. En cela, ils diffèrent profondément des insectes chez qui le système circulatoire est ouvert sans vaisseaux délimités.
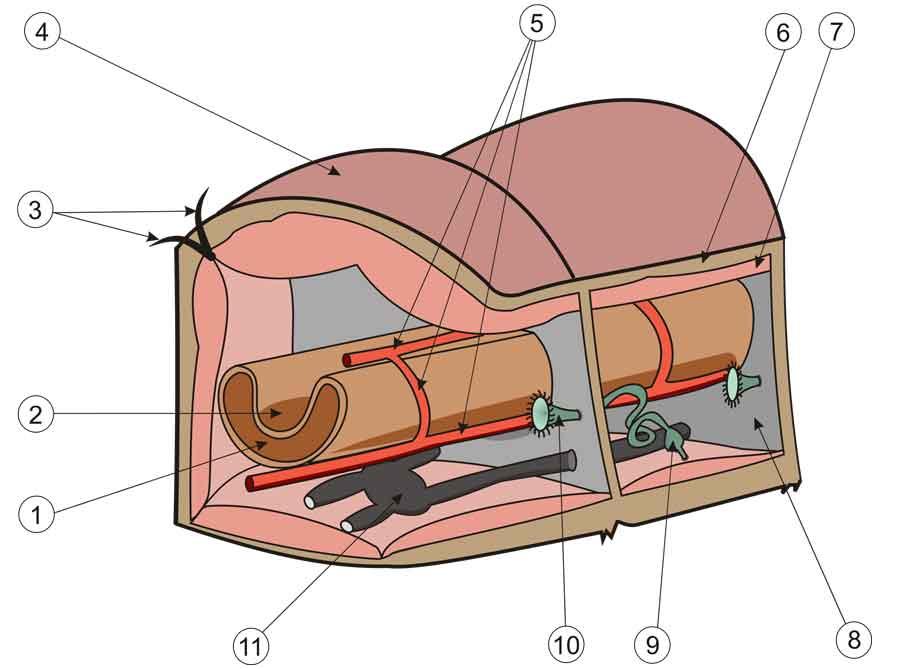
1) Lumière de l’intestin ; 2) Typhlosole = repli interne ; 3) Soies ; 4) Cuticule ; 5) Vaisseaux sanguins ; 6) Épithélium sous la cuticule ; 7) Muscles circulaires ; 8) Cloison ; 9-10) Néphridies (excrétion) ; 11) Ganglion nerveux. Image Reytan Public domain
Leur cavité générale est par ailleurs remplie d’un liquide clair, l’hémolymphe, qui baigne tous les organes internes. La « peau » fine (cuticule), molle (vaguement durcie) et élastique, enveloppe de manière étanche tout le corps qu’on pourrait comparer à un sac allongé plein de liquide. Ils n’ont ni squelette interne, ni exosquelette fortement durci comme les arthropodes (carapace des insectes et crustacés). Et pourtant, ils arrivent à se déplacer horizontalement, à se déformer, à se tortiller sur eux-mêmes de belle façon ! Comment font-ils ?
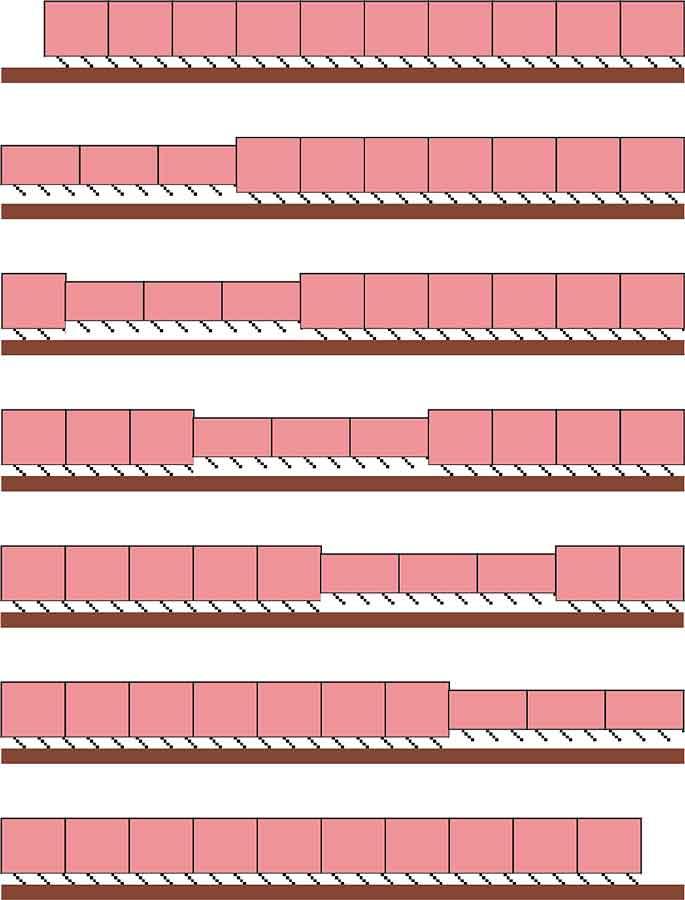
Ils possèdent sous leur « peau » deux couches de muscles antagonistes très développées : des muscles circulaires qui font le tour des anneaux en interne et des longitudinaux qui suivent le corps tout du long. Quand ces muscles se contractent, ils appuient ainsi sur le liquide interne qui, étant en vase clos, subit une forte pression qui tend le corps : on parle de squelette hydrostatique.
Quand les circulaires se contractent, ils resserrent les anneaux ce qui provoque l’allongement du corps qui peut doubler de longueur ; quand les longitudinaux le font, ils rétractent le corps en long ce qui le rétrécit. Avec cette alternance, les lombrics réussissent ainsi à se déplacer. D’autre part, ce dispositif leur permet de s’insinuer dans des fissures ou des fentes du sol très étroites qu’ils peuvent aussi élargir dans un sol meuble. Enfin, ces muscles entourent le tube digestif central (voir ci-dessous) et participent donc à faire progresser la nourriture ingérée tout au long du corps !
Pour progresser, ils s’appuient sur le substrat grâce aux soies latérales dures qui s’accrochent et ancrent le corps.
Si ce système peut paraître peu efficace en surface, il s’avère redoutablement efficace pour les déplacements à l’intérieur du sol. A noter qu’on retrouve un tel dispositif chez des larves vermiformes de diptères vivant dans le sol
Mal affranchis
Nous avons vu que les Lombrics se classent dans le groupe des Annélides : or, celui-ci comporte une majorité d’espèces aquatiques à semi-aquatiques. Autrement dit, les vers de terre représentent une lignée devenue terrestre au sein d’un groupe aquatique. Et parmi les parents proches des annélides au sens large, on ne trouve que des groupes essentiellement aquatiques comme les Mollusques ou les Némertes, les « vers rubanés ».
La lignée lombricienne aurait commencé à coloniser le milieu terrestre il y a environ … 600 millions d’années, soit bien avant que les premiers vertébrés ne s’aventurent hors de l’eau. En dépit de cette histoire très ancienne, ils ont conservé une forte dépendance envers la présence d’humidité dans leur environnement terrestre.
En fait, se comportent comme des animaux semi-aquatiques via leur mode de respiration. Ils ne possèdent pas d’organes respiratoires du type poumons ou branchies : les échanges gazeux se font directement et de manière passive, à travers la cuticule, entre la pellicule humide qui en baigne la surface et les vaisseaux sanguins juste de l’autre côté. C’est le mode respiratoire de tous leurs cousins aquatiques.
Si leur cuticule s’assèche, ils ne peuvent plus « respirer » au sens de faire des échanges gazeux car il n’y aucun mouvement respiratoire. Ils sont donc extrêmement dépendants de l’état d’humidité du sol dans lequel ils vivent et incapables de soutenir des périodes prolongées de sécheresse du sol. Ceci les exclut pratiquement des régions désertiques très sèches et aussi des régions très froides où le sol gèle profondément.

Lombrics trouvés à 70cm de profondeur en plein été par temps très sec en Espagne. Cliché Falzia11 C.C. 4.0
Pour survivre aux périodes de sécheresse épisodiques ou régulières, ils ont développé des stratégies d’évitement soit en s’enfonçant plus profondément si c’est possible pour être dans une zone moins affectée ou bien en entrant en vie ralentie. Dans ce cas, ils vident leur tube digestif et s’enroulent en boule serrée dans une loge qu’ils enduisent au préalable d’un ciment fait de leurs déjections liquides.
On distingue deux types de vie ralentie. Toutes les espèces peuvent entrer en quiescence qui est déclenchée soit par une sécheresse (estivation) ou par le gel (hibernation) ; cette sorte de dormance est levée dès que les conditions redeviennent favorables comme avec le retour de la pluie. Certaines espèces de grande taille ont la capacité d’anticiper les périodes de sécheresse via leur système nerveux et entrent en léthargie profonde durant les mois d’été ; on parle alors de diapause.
Hermaphrodite
Les Lombrics ont un développement direct sans passer par un stade larve : ils pondent des œufs qui éclosent pour donner directement des juvéniles semblables aux futurs adultes. Leurs proches cousines, les annélides Polychètes marines ont, elles, un développement indirect : les œufs donnent des larves ciliées planctoniques en forme de toupie (dites trochophores). Le passage à un développement direct constitue une adaptation à la vie en milieu terrestre.
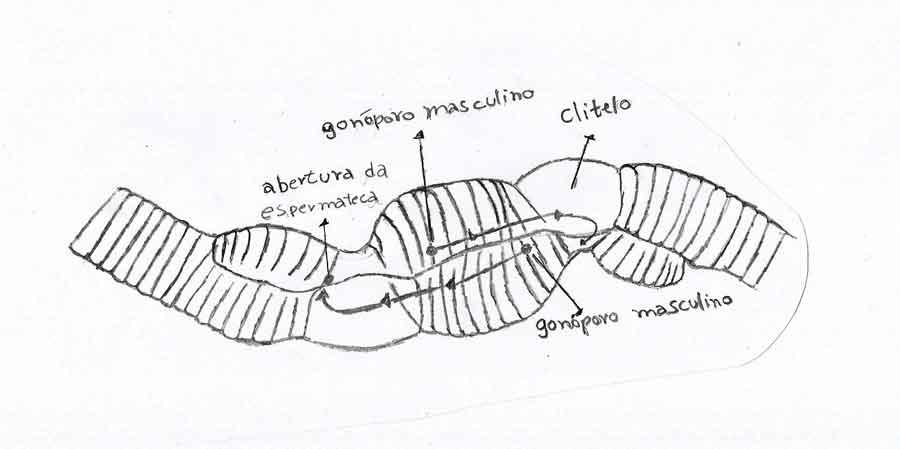
A l’éclosion, les juvéniles ne sont pas aptes à se reproduire. La maturité sexuelle n’est acquise qu’au bout d’un certain temps de croissance et marquée par l’apparition d’une structure typique de ces animaux (mais aussi des sangsues) : le clitellum. Il s’agit d’un bourrelet glanduleux, très visible, qui englobe de quatre à dix segments et en forme de gros anneau ou de selle dans la partie antérieure ; clitellum vient du latin clitellae qui signifie « bât ». Cette structure sert au moment de l’accouplement puis de la ponte. Elle est un très bon repère visuel pour savoir si on a affaire à ver adulte ou juvénile.
Les lombrics sont hermaphrodites : chaque individu possède des testicules qui communiquent avec deux pores mâles par où sont évacués les spermatozoïdes, juste en arrière du clitellum ; les ovaires sont reliés à un pore génital femelle situé lui en avant du clitellum avec une poche interne, la spermathèque, où sont stockés les spermatozoïdes acquis au cours de l’accouplement.
Ils s’accouplent de manière réciproque comme les escargots terrestres. Mais les organes mâles arrivent à maturité bien avant les organes femelles (plusieurs semaines) ce qui empêche toute possibilité d’autofécondation.
Les lombrics s’accouplent alors qu’ils sont au stade mâle : ils s’accolent tête bêche, unis par deux manchons muqueux secrétés par leurs clitellums respectifs. Les spermatozoïdes libérés par les pores mâles circulent le long d’une sorte de gouttière et vont rejoindre des poches de stockage ou spermathèques. Ils serviront à la fécondation quand les ovaires auront atteint la maturité.
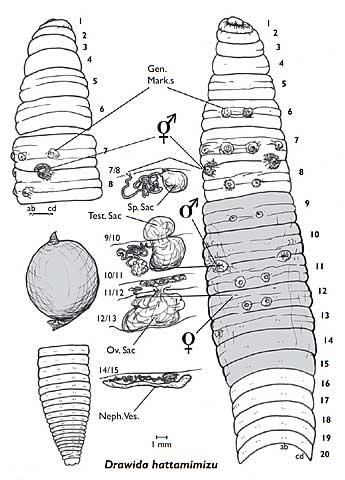
Pas simple tout ça : en plus, ce n’est pas fini !
Ponte
Quand les lombrics atteignent le stade femelle, chacun de leur côté, leur clitellum secrète un cocon muqueux. L’animal s’en extrait à reculons tout y en déposant les spermatozoïdes récupérés depuis les spermathèques puis les ovules. Le cocon se referme sur lui-même et forme une coque étanche et durcie (chitine) dans laquelle a lieu la fécondation des ovules. Chaque lombric, du fait de l’hermaphroditisme, peut pond produire des œufs.
Les œufs se retrouvent donc regroupés dans ce cocon muqueux dont la taille varie de 1 à 25mm selon celle des adultes. Chaque cocon peut renfermer jusqu’à une dizaine d’œufs mais le plus souvent seulement un ou deux. Le lombric dépose ce cocon dans le sol. L’enveloppe épaisse, durcie par de la chitine, presque imputrescible, forme une protection très efficace contre les conditions défavorables dont la sécheresse ce qui constitue une autre forme de résistance (voir ci-dessus) ; ainsi, même quand les populations adultes sont décimées par un épisode de sécheresse prolongée, l’espèce « renaîtra » grâce aux cocons. L’enveloppe protège aussi les œufs et embryons des agressions microbiennes et des champignons, très actifs dans le sol.
La fécondité varie beaucoup les espèces. Les lombrics des régions tempérées produisent en moyenne entre 20 et 60 cocons par an mais ce nombre descend à dix pour les grandes espèces.
Dans les œufs, les embryons entament leur développement direct, grâce au vitellus abondant qu’ils renferment et à la gélose nutritive qui remplit le cocon et dans laquelle ils baignent.
A noter qu’il existe des espèces de lombrics parthénogénétiques, i.e. se reproduisant de manière asexuée sans accouplement : les ovules non fécondés donnent de nouveaux individus. Il s’agit d’espèces à très vaste répartition mondiale et qui sont liées aux habitats très perturbés liés aux activités humaines.
Il reste un aspect de la biologie des lombrics dont nous n’avons pas tout parlé : l’alimentation et la digestion. Comme cette activité occupe une place centrale dans leur rôle écologique majeur dans la vie des sols, nous y consacrerons une chronique entière à part. Il y sera question, entre autres, du creusement des galeries, des turricules ces amas d’excréments déposés en surface, des incroyables transformations du sol qu’ils induisent …
Bibliographie
Classification phylogénétique du vivant. Tome 2. G. Lecointre ; H. Le Guyader. Ed. Belin 4ème édition. 2017.
Le sol vivant J-M. Gobat et al. Presses Polytechniques et Universitaires Romandes 2003
Soil Ecology. P. Lavelle; A. V. Spain. Kluwer academic Publishers 2001
The “intestines of the soil”: the taxonomic and functional diversity of earthworms – a review for young ecologists. Nico and Elina Eisenhauer. 2020