Sur la plage, les capsules des œufs de raies et de roussettes
21/10/2022 Elles sont l’un des nombreux « objets » naturels que les marées déposent inlassablement sur l’estran dans la bande de dépôt, la laisse de mer, une source inépuisable de découvertes et de surprises pour le promeneur naturaliste. Les anglo-saxons les ont surnommées joliment « bourses à sirène » (mermaid’s purse) (voir la capselle bourse à pasteur) à cause de leur forme de poche presque rectangulaire à texture rappelant celle du cuir. Elles intriguent par leur allure mais bien souvent notre intérêt ne va guère au-delà de l’étonnement : c’était mon cas jusqu’à cet automne où sur les plages de Vendée j’en ai croisé des dizaines échouées à l’occasion des grandes marées d’équinoxe ; j’étais persuadé qu’elles relevaient toutes d’une seule espèce de raie et je savais vaguement qu’elles renfermaient l’œuf véritable.
Piqué par la curiosité j’ai lancé une rapide recherche et me suis retrouvé devant une avalanche d’informations inattendues à leur propos dont la présence d’au moins dix espèces de raies sur nos côtes. J’ai aussi découvert que ces capsules échouées faisaient l’objet d’un programme de sciences participatives fort intéressant. Il n’en fallait pas plus pour initier la rédaction de cette chronique afin de partager cette rencontre indirecte avec ces êtres marins étonnants que sont les raies et roussettes, très proches parents des requins.
Sélaciens
Raies et roussettes se classent aux côtes des requins et chimères dans le groupe des Chondrichthyens, un nom difficile à mémoriser et à prononcer, que l’on traduit par « poissons cartilagineux ». Si l’adjectif convient bien (chondro signifie cartilage) pour ces animaux au squelette essentiellement fait de cartilage et recouvert d’une couche calcifiée, le nom de poissons créé une confusion avec les poissons osseux, les Téléostéens. Certes les Chondrichthyens ont bien une « forme de poisson » avec leur silhouette hydrodynamique et leurs nageoires mais pour le reste ils diffèrent profondément des « vrais » poissons : leur lignée a divergé très tôt dans l’histoire de l’évolution des vertébrés à mâchoires il y a plus de 450 millions d’années et ils ont suivi une voie évolutive très différente qui en fait un groupe très original. Quelque part, les assimiler à des « poissons » reste une manière sournoise de se les approprier comme source de nourriture et d’en pratiquer la pêche de manière éhontée : un bel exemple de notre facilité à « chosifier » les êtres vivants en ne les prenant pas en compte pas tels qu’ils sont, pour mieux ignorer les conséquences terribles de nos activités sur le monde vivant.
Entre autres différences fondamentales avec les poissons osseux, on notera la structure des écailles semblables aux dents (écailles dites placoïdes) et qui donne ce toucher râpeux à abrasif à leur peau (voir le cuir de « requin » appelé galuchat) et la présence chez les mâles d’organes spécialisés au niveau de la paire de nageoires pelviennes : les claspers pelviens ou ptérygopodes qui servent au moment de l’accouplement interne (versus le frai dans l’eau chez les poissons osseux, sans accouplement direct).
Au sein des Chondrichthyens, on distingue deux sous-groupes : les Holocéphales ou chimères et les Elasmobranches, les requins et les raies (au sens large car chacun de ces deux noms englobe une forte diversité de formes), que l’on peut assimiler à l’ancien groupe des Sélaciens, terme souvent connu du grand public. Les raies sont en fait des requins ayant évolué vers des formes à corps aplati dorso-ventralement et les roussettes sont des requins typiques.
Ovipares
Au niveau de la reproduction, outre la capacité à pratiquer des accouplements internes, les sélaciens se distinguent par une production limitée de descendants à chaque cycle de reproduction ; on parle de stratégie K avec des individus vivant longtemps mais produisant peu de descendants par opposition à la stratégie R des poissons osseux qui produisent des milliers, voire des millions d’œufs fécondés dans l’eau et sans véritable coque protectrice. Ainsi, les raies ne pondent en moyenne que 40 à 150 œufs par an et ne se reproduisent qu’au bout de 5 à 10 ans. On comprend rapidement les conséquences désastreuses de la pêche industrielle sur ces espèces à croissance lente et fécondité faible. Au moins deux espèces sont d’ailleurs inscrites en France sur la liste des espèces en danger critique d’extinction : la raie blanche et le pocheteau gris.

Oeuf de requin chabot gris dans sa capsule (Aquarium de Talmont ; 85) 
Le chabot gris, requin tropical, appartient à l’une des rares familles de requins ovipares
S’il semble qu’à l’origine les sélaciens étaient ovipares (pondant des œufs), on constate que de nombreuses lignées ont ensuite évolué vers des formes de viviparité (donner naissance à des petits vivants directement) soit par ovoviviparité (conserver les œufs dans le corps jusqu’à leur éclosion interne) ou par viviparité complète (embryons nourris directement par les voies reproductrices de la femelle ou par cannibalisme envers d’autres embryons surnuméraires). Globalement, la viviparité concerne environ 60% des 1010 espèces actuelles et donc 40% sont ovipares. Les analyses phylogénétiques indiquent qu’au moins à 9 ou 10 reprises de manière indépendante la viviparité est apparue à partir de formes ancestrales ovipares. Mais inversement, l’oviparité a évolué secondairement (réversion) à partir de formes vivipares dérivées notamment à la base de la lignée des raies (Rajidés) qui actuellement sont toutes ovipares. Ainsi curieusement, les raies ovipares (donc proches de l’état ancestral) sont plus récentes que les raies vivipares. Par ailleurs, chez les requins, l’oviparité existe dans trois familles dont, en Europe, celle des Scyliorhinidés, les roussettes, des petits requins (150 espèces).
Les sélaciens ovipares sont donc majoritairement des raies (plus de 600 espèces dont environ 50 sur les côtes européennes) ; par rapport aux espèces vivipares, ce sont en général des espèces vivant sur le fond (benthiques), proches du littoral et rarement de grande taille. Elles produisent des jeunes de taille bien plus petite que chez les espèces vivipares du fait de la quantité limitée de réserves nutritives disponibles dans les œufs (vitellus ou jaune d’œuf). Leur mode de vie littoral explique ainsi que l’on trouve régulièrement les enveloppes de leurs œufs ou capsules échouées sur les plages.
Œufs
Nous allons maintenant détailler le processus de fabrication des œufs et leur ponte en prenant comme exemple les roussettes dont deux espèces vivent sur nos côtes et sur lesquelles plusieurs études ont été publiées.
Dans les voies génitales des femelles, les ovules, produits par les ovaires, descendent en empruntant les oviductes jusqu’à une « poche » ou glande nidamentaire où a lieu la fécondation, la rencontre avec les spermatozoïdes déposés par le mâle lors de l’accouplement avec ses claspers (voir ci-dessus). Chaque œuf fécondé comporte une masse vitelline ou jaune portant un disque embryonnaire et entouré d’une gelée dense. La glande nidamentaire secrète en même temps une enveloppe protectrice, la capsule dans laquelle l’œuf entre et sur lequel elle se referme. Ensuite, tout le développement de l’embryon jusqu’à la naissance d’un « bébé » roussette se déroule à l’intérieur de cette capsule. Il se nourrit à partir des réserves nutritives du jaune jusqu’à leur épuisement complet. Passés les premiers stades de développement après la ponte au fond de la mer (voir ci-dessous), des petites fentes fermées par des bouchons muqueux rigides s’ouvrent aux quatre coins de la capsule ce qui facilite les échanges avec l’eau de mer et notamment l’apport d’oxygène. L’embryon, dès qu’il commence à prendre forme, agite sa queue ce qui assure le renouvellement de l’eau à l’intérieur de la capsule. Au cours de sa croissance, l’embryon développe ses nageoires pectorales que se replient au-dessus de son dos tandis que la queue se courbe sur le côté. Cette longue croissance s’étale sur 5 mois à un an selon les espèces.
Capsules high tech
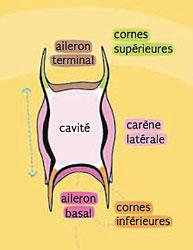
Poursuivons, toujours avec l’exemple des roussettes, en détaillant la capsule. Cette enveloppe de teinte vert jaunâtre à brune (petite roussette) présente une forme ovale à rectangulaire avec un rebord plus épais qui l’encadre. Les deux extrémités sont différentes : plate et sans rebord d’un côté et courbée renforcée de l’autre. Elle se prolonge à chacun des quatre angles par une longue vrille entortillée en spirale, semi-transparente et qui s’amincit vers son extrémité. La capsule des raies diffère sensiblement par l’absence de vrilles terminales et l’allongement marqué des quatre angles en cornes amincies au bout ; elle porte souvent des « ailes » latérales (carènes) ou terminales (ailerons).
Très résistante, nettement rigide, cette capsule a une texture lisse faisant penser à du cuir ; elle est flexible mais non élastique : on peut la courber mais pas l’étirer. Sa rigidité relative en dépit de sa légèreté s’explique par sa composition chimique et l’arrangement physique des molécules constitutives. Sur une armature de kératine, la protéine qui constitue nos ongles, cheveux et poils, sont disposés des brins de collagène, une autre protéine bien connue qui assure la cohésion et l’élasticité de la majorité de nos tissus corporels. Ces brins sont assemblés en une structure en 3D très complexe. Les molécules de collagène se regroupent en fibrilles parallèles (faisceaux de 100nm de diamètre) qui elles-mêmes s’agrègent en lamelles de 0,5mm d’épaisseur. Celles-ci forment une structure du même type que le contreplaqué et représentent 98% de l’épaisseur de la capsule ; l’orientation des fibrilles change de lamelle en lamelle ce qui en renforce la solidité. La surface externe très mince (les 2% restants), souvent de couleur foncée et réfringente se compose de nombreux granules protéiques.
Cette structure hautement perfectionnée combine résistance mécanique et rigidité tout en conservant une forte perméabilité aux petites molécules et aux ions. Ceci explique que une fois échouées les capsules vides peuvent persister longtemps tout en se rétractant sensiblement sous l’effet du dessèchement.
Ponte et éclosion
Chez la plupart des espèces, les œufs sont déposés en des sites réutilisés régulièrement année après année où viennent se concentrer la majorité des femelles du secteur : on parle de nurseries. Elles se situent près du littoral, dans des eaux peu profondes, sur des fonds marins rocheux ou dans les peuplements denses d’algues. Dans de telles nurseries on estime la densité de capsules à près de 800 000/km2. La ponte peut avoir lieu toute l’année mais avec un pic saisonnier marqué au printemps et en été

Les œufs sont accrochés aux rochers ou aux algues grâce aux vrilles muqueuses chez les roussettes ou aux cornes chez les raies. Chez les raies, les capsules sont pondues deux par deux (une produite par ovaire) chaque jour ou à intervalles d’une semaine. Les femelles quittent la zone aussitôt la ponte terminée et ne s’occupent aucunement du devenir de leurs pontes. Des organismes marins fixés (algues, bryozoaires, hydrozoaires, spirorbes, …) peuvent se fixer sur les capsules et participent peut-être à leur camouflage vis-à-vis des prédateurs.
Juste avant l’éclosion, la jeune roussette formée dans la capsule pivote et oriente sa tête vers l’ouverture aplatie et place sa queue contre l’ouverture courbée. Elle force avec sa tête et ouvre le côté plat en s’aidant des écailles dentelées sur son museau ou ses nageoires ; celles-ci tomberont aussitôt après la sortie à l’instar du diamant sur le bec des jeunes oiseaux. La sortie de la jeune roussette ou de la jeune raie complètement formée et d’emblée autonome (i.e. capable de chasser) s’effectue en quelques minutes, allant parfois jusqu’à une heure. Les jeunes quittent ensuite les nurseries et se dispersent.
Échouage
Une fois l’éclosion effectuée, la capsule vide finit tôt ou tard par se décrocher à la faveur des tempêtes qui agitent le fond de l’eau dans les zones peu profondes des nurseries. Devenues très légères tout en conservant leur résistance, elles sont entraînées par les courants et les vents et finissent donc par échouer sur les plages dans les laisses de mer déposées au plus haut niveau atteint par chaque marée haute. Les plages se trouvant face à des zones de nurseries peuvent ainsi recevoir des dizaines de ces capsules qui vont ensuite persister plusieurs années ; certaines finissent même par atterrir dans les dunes, poussés et soulevées par les vents violents. D’ailleurs leur capacité de résilience à la décomposition a longtemps intrigué et suscité moult croyances en plus de leur aspect singulier.
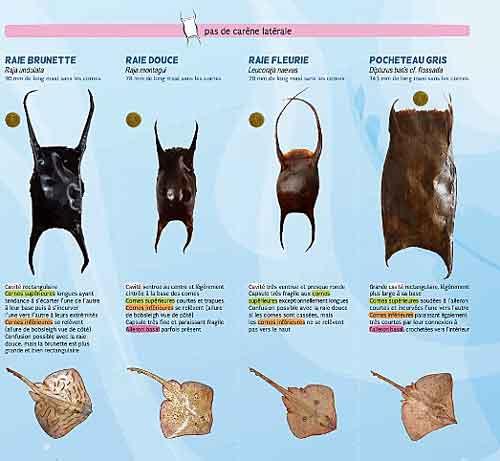
Comme la forme et la taille des capsules sont des critères spécifiques, on peut assez facilement identifier les espèces de raies ou de roussettes qui les ont produites. Il se peut d’ailleurs que ces différences de forme (dont la longueur des cornes chez les raies) reflètent des habitats de nurseries sensiblement différents. Pour identifier correctement l’espèce, il faut faire tremper la capsule dans de l’eau douce pendant une à deux heures (immergée) afin qu’elle se réhydrate et reprenne ses mensurations initiales. Les capsules les plus grandes peuvent requérir jusqu’à 24 heures de trempage avant de retrouver leur forme.
La collecte de ces capsules échouées et leur examen attentif permet donc indirectement de connaître la répartition des espèces et leur abondance relative. D’autre part, l’observation très rapprochée permet de détecter des traces éventuelles de prédation (voir ci-dessous) et apporte ainsi de précieux renseignements sur cet aspect important pour l’évolution des populations souvent en fort déclin du fait de la pêche intensive.
Un programme de Sciences participatives (voir la chronique sur cette pratique) à l’échelle européenne a été initié depuis plus d’une décennie par l’association Sharktrust (voir en bibliographie) avec un site richement documenté. Ce programme se décline dans différents pays dont la France via l’association ASPECS (Association pour l’étude et la conservation des Sélaciens) et son programme CapOeRa (Capsules Œufs de Raies) qui consiste à suivre la présence des raies ovipares des côtes françaises à travers la collecte régulière des capsules échouées; sur le site très bien documenté, on trouve des témoignages d’actions menées et une fiche d’identification qui présente les sept espèces de raies que l’on trouve sur la façade atlantique ; les roussettes ne sont pas incluses dans ce programme.
Les capsules échouées dans les laisses de mer deviennent des abris pour la petite faune spécialisée de ce milieu et sont probablement grignotées par certaines espèces vu leur contenu protéique.
Prédation
Compte-tenu de la longue durée d’incubation, on peut penser que ces œufs non cachés, déposés sur le fond marin, doivent être soumis à une certaine prédation. On dispose de peu de données d’observations directes d’animaux en train de prédater ces œufs. Par contre, via les traces d’effraction laissées par les prédateurs, on peut accéder à des évaluations de l’intensité de cette prédation.
Une étude récente a été conduite au Danemark à partir de capsules recueillies par des bénévoles justement dans le cadre des programmes de Sciences participatives évoqués ci-dessus : une observation à la loupe au laboratoire a permis d’obtenir des données intéressantes. 14,4% des capsules examinées dans le cadre de cette étude présentaient des perforations ou déchirures imputables à des prédateurs. D’autres études antérieures menées dans d’autres pays donnent des chiffres souvent supérieurs (jusqu’à 42% en Californie) mais à partir de protocoles différents (par exemple prélèvements par dragage). Une des explications possibles à ces différences serait que les œufs prédatés ne flottent pas comme les œufs éclos et s’échouent en moins grand nombre.

Natices 
Murex perceur 
Buccin 
Pourpres (de toutes les couleurs) près des moules, une de leurs proies favorites 
Coquille de Lamellibranche forée par la radula d’un Gastéropode
Quatre types de traces ont été inventoriées. Les perforations de section parabolique ou ronde sont imputables à des gastéropodes carnivores qui percent les coquilles des mollusques avec leur radula ou langue dure et râpeuse ; diverses espèces et genres sont très présents sur les côtes atlantiques (comme en attestent les nombreuses coquilles vides échouées) et suspectés de participer à cette prédation : les natices (Euspira) ; le cormaillot ou murex perceur (Ocenebra) ; le pourpre ou pilau (Nucella) ; le buccin ondulé ou bulot (Buccinum) le perceur d’huîtres (Urosalpinx) auxquels s’ajoutent plusieurs espèces invasives introduites. Les perforations allongées et irrégulières imputables soit aux pieuvres (qui déchirent la capsule avec leur bec corné) soit à certains crabes. On sait que les populations de pieuvres connaissent une forte augmentation au cours de la dernière décennie. Il s’agit donc d’une prédation non négligeable au regard du déclin général des raies et roussettes.
Sur près de 38% des capsules prédatées, on observe en plus des mini-trous incomplets qui témoignent d’une activité de repérage préalable pour choisir le site de perforation adéquat. Or ce comportement est justement connu de la part des gastéropodes et des pieuvres ce qui renforce l’idée qu’ils sont bien les prédateurs principaux. Par ailleurs, on sait que les gastéropodes perceurs, lors du perçage, créent un champ électrique ; or, il a été observé que les embryons de raies sont capables de détecter un champ électrique et cessent alors leurs mouvements de queue servant à ventiler l’eau dans la capsule (voir ci-dessus) ce qui décourage le prédateur en repérage. Ce comportement original serait une forme d’adaptation permettant de limiter la prédation.
On voit que ces faux-poissons que sont les raies et roussettes se montrent capables de bien des prouesses « techniques », physiologiques et comportementales, loin de l’image « d’êtres inférieurs » liée au fait qu’ils ont un squelette cartilagineux et non osseux … comme nous bien entendu. Quelque part, ils ont inventé, bien avant les oiseaux et les lézards et serpents, l’oeuf à « coquille ».
Bibliographie
Site de l’association Sharktrust
Site de l’association ASPECS (programme CapOeRa)
X-ray diffraction analysis of the 3D organization of collagen fibrils in the wall of the dogfish egg case Carlo Knupp and John Squire Proc. R. Soc. Lond. B (1998) 265, 2177-2186
Characterization of Selachian Egg Case Collagen Thanh-Truc Luong et al. BIOCHEMICAL AND BIOPHYSICAL RESEARCH COMMUNICATIONS 250, 657–663 (1998)
Evolutionary transitions among egg-laying, live-bearing and maternal inputs in sharks and rays NICHOLAS K. DULVY AND JOHN D. REYNOLDS Proc. R. Soc. Lond. B (1997) 264, 1309-1315
Oviparous elasmobranch development inside the egg case in 7 key stages. Musa SM, Czachur MV, Shiels HA (2018) PLoS ONE 13(11):
An identification key for Chondrichthyes egg cases of the Mediterranean and Black Sea. Mancusi et al. (2021) The European Zoological Journal, 88:1, 436-448 Cet article renferme une clé d’identification des capsules pour la Méditerranée (en anglais)