La galle lenticulaire du chêne
24/08/2023 Nous avons parcouru le monde foisonnant des cynips, ces petites guêpes dont les larves vivent dans des galles induites sur des plantes hôtes . Nous avons vu que la famille (Cynipidés) comportait plusieurs tribus, chacune plus ou moins inféodée sur un groupe de plantes restreint. La tribu la plus diversifiée est celle des Cynips des chênes qui regroupe un tiers de toutes les espèces que compte cette famille.
La lignée des cynips des chênes a connu une évolution foisonnante avec une très grande diversité de formes des galles mais aussi des variations dans le cycle de reproduction dont nous avons présenté l’extrême complexité (chronique). Compte tenu de leur importance écologique et des belles surprises que révèle leur mode de vie, nous allons consacrer quelques chroniques pour entrer dans l’intimité des espèces les plus communes et les plus faciles à observer. La galle lenticulaire du chêne, objet de nombreuses études scientifiques, va inaugurer cette série de « monographies ».
Lentille ou parasol
Pour observer cette galle commune, il faut explorer le dessous de feuilles de chênes sessile ou pédonculé, entre juillet et octobre au plus tard.
Elle se présente sous la forme d’un disque aplati, plaqué contre la face inférieure d’une feuille ; légèrement bombée au sommet, son diamètre atteint 4 à 4,5mm et sa hauteur en coupe 0,7 à 0,9mm. Ce disque est fixé sous la face inférieure des feuilles via un très court pédoncule raccordé au centre de la galle par en-dessous. René-Antoine Ferchaut de Réaumur (1683-1757), célèbre physicien et naturaliste, l’avait surnommée galle-parasol ou galle-champignon, deux images qui lui conviennent parfaitement !
Le plus souvent, on en trouve au moins quelques-unes a minima par feuille occupée mais, elles peuvent être très nombreuses, pouvant couvrir toute la surface d’une feuille au point de se chevaucher entre elles. On en a compté jusqu’à 120 sur une même feuille. Dans ce dernier cas, elles peuvent se déformer un peu et perdre leur apparence bien régulière.
Si on en détache une, on voit que le dessous est presque plat avec un léger creux autour du point d’insertion du pédoncule et que le bord est légèrement recourbé vers la feuille.
La couleur de fond varie entre vert, jaune ou blanc selon la quantité de chlorophylle contenue dans les tissus superficiels. Une pigmentation rougeâtre vient se surajouter.
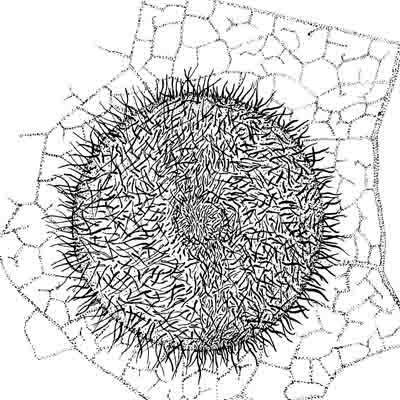
Mais le caractère le plus distinctif concerne la pilosité la surface supérieure de cette galle. Des poils étoilés rougeâtres, bruns ou pourprés hérissent la face supérieure de la galle par bouquets d’une dizaine en moyenne. Ils occupent toute la surface en se densifiant vers le mamelon central et sur le rebord externe. Durcis et lignifiés, ils renferment des pigments (d’où leur coloration) et des tanins. Ils émanent de cellules épidermiques transformées. La face inférieure tournée vers la feuille en est quasiment dépourvue sauf quelques-uns vers le rebord.
L’épiderme de surface est revêtu d’une cuticule assez épaisse et cireuse, sur les deux faces.
Avec tous ces caractères réunis, il est quasi impossible de confondre cette galle avec d’autres espèces.
Chambre larvaire
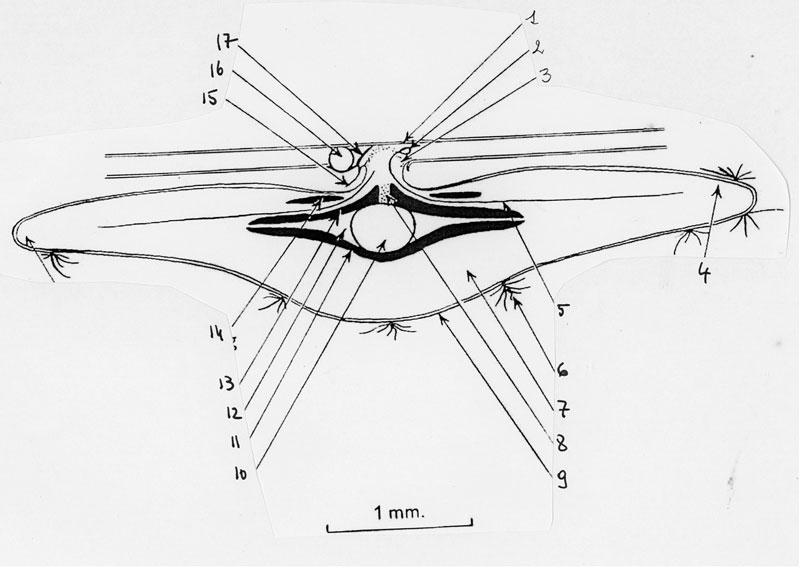
Passons maintenant à l’intérieur d’une telle galle-lentille bien développée (en août), là où vit la larve, sorte de petit ver blanc sans pattes (voir chronique cynips).
Au centre, la larve se tient dans une chambre sphérique, un peu aplatie horizontalement. De part et d’autre, formant comme deux couvercles, se tiennent deux plaques durcies (sclérenchyme : tissu à membranes lignifiées) doublées d’un anneau durci autour du pédoncule qui « s’enracine » dans la galle par une masse de cellules lignifiées. En dehors des plaques, l’essentiel de la masse de la galle est occupé par un tissu de type indifférencié riche en amidon, le parenchyme de stockage ou cortex. Aux extrémités, vers le rebord du disque, le tissu devient plus lacunaire avec des espaces remplis d’air.
Si le pédoncule émane de la feuille, les tissus constitutifs de la galle n’en sont pas moins en continuité avec ceux de la feuille : il s’agit bien d’une construction de novo, taillée sur mesure pour les besoins de la larve qui en dirige la mise en place ! Un cylindre vasculaire (contenant les vaisseaux où circulent les sèves) relie la feuille à la galle en passant par le pédoncule. C’est par là qu’arrivent tous les nutriments détournés par la galle qui se met en place : elle fonctionne comme un puits de ressources pour le chêne hôte (voir chronique Cynips).
Entre les deux plaques et la chambre, on trouve un tissu particulier, le tissu nutritif. La larve, au corps en forme de C, se tient au centre, couchée à l’horizontale et grignote les cellules devant sa tête armée de deux mandibules.
Dans la chronique sur les cynips, nous avions vu que l’intérieur des galles restait remarquablement constant en dépit des fortes variations externes de forme et d’ornementations, avec un élément central typique : une coque ligneuse interne qui enveloppe le tissu nutritif (galle interne). Or, ici, ce n’est justement pas le cas : il n’y a pas de coque interne. Elle est remplacée par ces deux plaques non réunies, juste superposées à la manière des cymbales Charleyston des batteries !
Par contre, on retrouve bien les trois couches concentriques successives en partant de la chambre : tissu nutritif, parenchyme cortical et épiderme.
Curiosités
Des observations microscopiques ont mis en évidence plusieurs singularités de cette galle.
Sur les galles matures, en automne, on observe des ouvertures perchées au sommet de protubérances épidermiques, isolées ou par petits groupes ; elles font penser à des stomates dégénérés, ces ouvertures qui, sur les feuilles, permettent les échanges gazeux avec l’intérieur de la feuille.
On connaît effectivement des stomates ainsi disposés sur les calices des physalis par exemple. Ceci laisse à penser que ces ouvertures doivent servir à faciliter les échanges gazeux et permettre la respiration de la larve complètement enclose dans la galle fermée. Mais, elles constituent aussi des portes d’entrée pour des microorganismes infectieux.
Autre singularité : la présence de cristaux d’oxalate de calcium dans les plaques de sclérenchyme qui encadrent la chambre larvaire (voir ci-dessus). Ils pourraient servir de barrière contre le passage de parasites, d’herbivores ou d’inquilins (voir la chronique Cynips). Ces cristaux peuvent repousser des insectes aux pièces buccales broyeuses (très vulnérants et toxiques) mais pas des insectes piqueurs suceurs. D’ailleurs, ces galles se font régulièrement consommer par des chenilles qui grignotent les feuilles et détruisent les galles et leurs occupants en même temps.
Ces cristaux viennent en complément des touffes de poils, de la cuticule épaisse, des tanins et des deux plaques durcies. Mais cet arsenal n’arrête en aucun cas les divers hyménoptères parasitoïdes (voir dernier paragraphe) qui piquent à travers l’épaisseur de la galle avec leur long ovipositeur.
Ponte
La ponte initie le développement de la galle. Chaque œuf est inséré par la femelle dans les tissus de la feuille choisie à l’aide de son fin ovipositeur. Cette insertion se fait avec très peu de dégâts : quelques dizaines de cellules au plus écrasées ou détruites … Et pourtant, ceci va suffire à lancer ce processus fascinant de l’élaboration par la plante hôte d’un organe complètement nouveau pour elle !
Une observation très fine a révélé que chaque œuf est systématiquement pondu contre une nervure secondaire qui doit lui servir d’appui ; en tout cas, les cellules de ces nervures ne participent pas à l’élaboration de la galle. Chaque œuf est introduit en biais du fait de la position de la femelle et de la forme de son ovipositeur.
Les œufs sont soit régulièrement espacés selon des lignes ou bien de manière désordonnée.
Des chercheurs suisses ont utilisé une grande grue permettant d’explorer les arbres d’une forêt jusqu’à la canopée pour étudier la répartition des galles et donc indirectement des sites de pontes. Ils ont trouvé un taux d’infestation des feuilles de l’ordre de 0,3 galles par feuille. Ces galles sont réparties de manière égale entre les branches basses et la canopée.
Par contre, ils ont noté une nette préférence pour le chêne sessile par rapport au chêne pédonculé quand les deux coexistent. Le fait le plus marquant concerne le choix préférentiel de certains arbres individuels où se concentrent les galles.
On avait émis autrefois à ce propos l’hypothèse dite du synchronisme phénologique : le débourrement des bourgeons foliaires serait le signal déclencheur pour choisir les sites de ponte ; donc, il faudrait que le gonflement du bourgeon coïncide avec l’émergence des femelles. Les arbres précoces ou tardifs échapperaient ainsi aux pontes et donc aux galles. Or, dans l’étude suisse, cette hypothèse n’a pas été confirmée : les densités de galles ne sont pas corrélées avec les dates de débourrement des bourgeons.
En fait, cette hypothèse reposait sur la supposition que ces insectes avaient une capacité de dispersion limitée. Or, ce n’est sans doute pas le cas ; ainsi, alors que les femelles émergent au sol (voir ci-dessous), elles pondent jusqu’au sommet des arbres ce qui relativise leur soi-disant dispersion limitée.
Que la galle soit …
Le développement complet prend de quatre à six mois au total … et encore, il y aura des prolongations (voir ci-dessous).
Aussitôt l’œuf pondu, des transformations se mettent en place au point d’insertion. Sous l’œuf, des cellules se liquéfient après dissolution de leurs parois ce qui engendre un petit creux. Quand la larve éclot trois semaines après la ponte, elle rampe directement vers ce creux autour duquel commence à se former un coussinet, ébauche de la galle.
La larve commence à se nourrir en broyant les cellules devant sa tête : cette activité initie la formation de cellules du tissu nutritif (voir ci-dessus).
Une semaine plus tard, une couche de tissu nutritif se forme devant sa tête, là où elle se nourrit. Alimentées par un nouveau faisceau vasculaire relié à une nervure proche, ces cellules nutritives se développent rapidement. Le bourrelet initial traverse l’épiderme inférieur de la feuille et commence déjà à développer des touffes de poils.
Cinq semaines après la ponte, une couche de cellules ligneuses s’amorce autour du tissu nutritif et la jeune galle entame son expansion latérale en disque. Un massif de cellules indifférenciées (méristème comme dans les bourgeons) s’active aux extrémités du disque et assure la croissance autonome de la galle. La forme en disque se trouve en fait induite par le comportement alimentaire de la larve : elle mange tout en tournant en rond dans sa chambre mais en restant dans un plan horizontal.
Deux semaines plus tard, le tissu nutritif tapisse entièrement la chambre circulaire et les deux plaques durcies sont en place de part et d’autre (voir ci-dessus).
Seconde vie
En octobre, la galle est devenue le disque aplati que nous avons décrit. Mais, contrairement à la majorité des galles de feuilles, elle se décroche avant la chute des feuilles. Son pédoncule se lignifie et la chute semble provoquée par le vent qui entraîne la rupture.
Comme elle tombe bien avant les feuilles, elle va ensuite être recouverte par celles-ci et ainsi protégée des intempéries (froid hivernal notamment), du dessèchement et d’une partie des prédateurs. Ceci dit d’autres prennent le relais comme les mulots qui les rongent et consomment la larve.
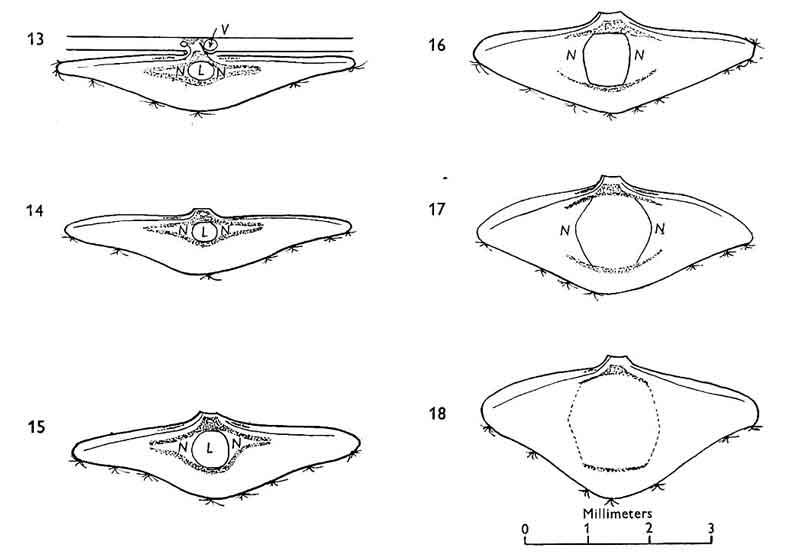
Autre singularité : la larve dans la galle continue de se développer et accélère même sa croissance qui était jusque-là relativement lente. Si la galle reste accrochée sur la feuille, la larve meurt !
Dans la galle tombée au sol, le parenchyme et le tissu nutritif s’étendent en hauteur, utilisant pour ce faire les réserves d’amidon accumulées : la galle grossit et change de forme. Sans les deux plaques rigides faisant office de « squelette » la galle ne pourrait pas ainsi s’agrandir.
La larve consomme toutes les cellules nutritives et ensuite, sa taille maximale atteinte, entre en hibernation dans la chambre élargie. Les tanins dans les cellules du parenchyme, les touffes de poils et la cuticule isolent la larve des rigueurs hivernales en plus du tapis de feuilles mortes.
La larve se nymphose (voir chronique Cynips) dans la galle et au début du printemps, en mars, elle éclot pour libérer un adulte.
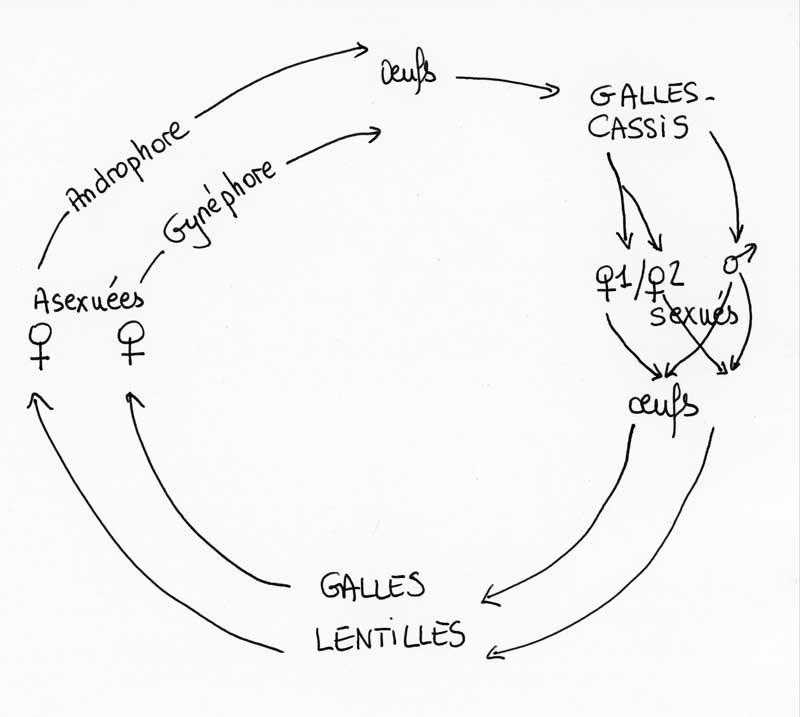
Seconde génération
Les adultes qui émergent alors des galles-lentilles tombées au sol sont tous des femelles qui vont se reproduire par parthénogénèse (voir Cynips). Cette nouvelle génération asexuée s’envole aussitôt et va pondre directement (sans accouplement préalable) surtout sur de très jeunes feuilles (nous sommes en mars) ou des chatons mâles (inflorescences des chênes : voir la chronique sur les fagacées).

Galles-cassis sur jeunes feuilles 
Galles sur chatons (cliché L.F. Garcia ; C.C. 4.0.) 
Galles-cassis tombées au sol (cliché Helene RB ; C.C. 0.)
Ces œufs, et les larves qui en sortent, engendrent de nouvelles galles complètement différentes, en forme de petites billes charnues rouges. Elles sont souvent en nombre sur un même chaton, ressemblant alors à une grappe de groseilles ou de cassis (d’où le nom anglais de currant gall).
Le développement des larves se fait bien plus rapidement que dans les galles lentilles ; les larves profitent sans aucun doute de la poussée de sève extraordinaire qui accompagne la reprise d’activité des chênes. Ainsi, dès juin, les larves se nymphosent ; les galles virent au brun et tombent au sol. Comme elles sont souvent très nombreuses, elles peuvent alors tapisser la litière de feuilles au sol !
Rapidement, va éclore la seconde génération avec des mâles et des femelles qui vont s’accoupler. Les femelles fécondées pondent des œufs qui vont cette fois donner les galles lentilles porteuses de la génération asexuée future !
Comme chez le cynips du sycomore pris comme exemple de cycle hétérogone (chronique Cynips), les femelles de la génération asexuée sont de deux types : des androphores qui pondent des œufs ne donnant ensuite (après développement) que des mâles et des gynéphores qui ne donnent que des femelles.
Mais, comme cette espèce ne fait décidément rien comme les autres, il y a une complication supplémentaire dans ce cycle, pourtant déjà « prise de tête » pour le non-initié ! Parmi les femelles de la génération sexuée (celle qui engendre les galles lentilles), il y a en fait deux types de femelles (notées 1 et 2 sur le cycle) : les unes après fécondation pondront des œufs qui donneront des femelles asexuées androphores et les autres des femelles gynéphores. Tout le monde suit ??
Si vous ne deviez retenir qu’un résumé ultra condensé, ce serait : galles-lentilles = génération asexuée ; galles-groseilles = génération sexuée !
Interactions
Nous avons qualifié les galles de puits de ressources pour l’arbre porteur : elles détournent à leur profit les produits de la photosynthèse effectuée par les feuilles. Pour autant, à part peut-être dans les cas de surabondance ou de coïncidence avec d’autres stress environnementaux (comme les sécheresses …), a priori cela affecte peu la croissance des arbres porteurs.

Souvent, les galles lentilles cohabitent avec d’autres espèces proches, dont celles du même genre Neuroterus) sur les mêmes feuilles : la galle bouton de guêtre soyeux (N. numismalis) très commune ou la galle-lentille blanchâtre (N. albipes) plus rare. On pourrait donc penser qu’elles se concurrencent. Mais, des observations fines montrent qu’elles se répartissent différemment sur les arbres et sur les feuilles. Ainsi, numismalis se trouve surtout dans la canopée et près de la pointe des feuilles, albipes sur les branches proches du sol et sur le tiers basal des feuilles tandis que la galle-lentille tend à occuper des positions intermédiaires tant sur les arbres que les feuilles.
Ces galles subissent une très forte pression de la part de tout une communauté d’hyménoptères parasitoïdes, i.e. qui pondent leurs œufs sur ou dans les larves de cynips ; leurs larves vont consommer lentement la larve de cynips encore vivante jusqu’à la tuer. On connaît des dizaines d’espèces de ces parasites dont beaucoup sont hyper spécialisées, i.e. très spécifiques d’une espèce de cynips. En plus, les larves de ces derniers peuvent être à leur tour parasitées par d’autres espèces dites hyper-parasitoïdes, générant ainsi une biodiversité incroyable autour de ces seules galles !

Torymus ornatus sur une galle de Cynips (autre espèce) : parasitoïde qui va insérer un oeuf avec son ovipositeur (cliché Slimguy ; C.C. 4.0.) 
Synergus (Cynips inquilin sur N. albipes) (Cliché A. Staverlokk ; C.C. 4.0.)
Dans une étude, on a trouvé un taux de parasitisme des galles-lentilles de 99,4% et ceci semble être la norme ; donc, l’impact de ces galles s’en trouve limité même si elles vont effectuer presque toute leur croissance tant que la larve est vivante. D’un arbre à l’autre, le taux de parasitisme peut varier considérablement dans un même peuplement. On a aussi montré que les espèces parasites se succédaient au fil de la croissance de la galle selon la taille de celle-ci.
Outre les parasitoïdes, il y a aussi les inquilins, ces squatters qui colonisent les galles occupées pour s’en nourrir et finissent par faire mourir l’occupant par compétition. Une partie d’entre eux (genre Synergus) sont d’ailleurs des Cynips d’une tribu spécialisée dans ce mode de vie (voir chronique Cynips) : ils implantent leurs œufs très tôt dans le développement de la galle. Mais on trouve aussi des inquilins appartenant à d’autres ordres d’insectes comme des petites mouches connues comme mineuses de feuilles, les cécidomyies : Parallelidopsis galliperda la larve se développe dans l’espace entre la galle lentille et la feuille, en-dessous !
On atteint avec ces exemples les vertiges de l’infinité de la biodiversité et des réseaux d’interactions qui se tissent entre espèces.
Bibliographie
Plant Galls Margaret Redfern. Ed. Harper Collins. 2011 Comme tous les ouvrages richement illustrés de cette remarquable collection « so british », c’est une mine d’or pour découvrir la folle diversité de l’univers des galles (en anglais … of course !). Nous l’avons beaucoup utilisé pour cette chronique.
Factors affecting parasitism in the oak-galler Neuroterus quercusbaccarum (Hymenoptera: Cynipidae) O. Plantard et al. 1998. Oikos 81 : 289-298
Anatomy and Ultrastructure of Galls Induced by Neuroterus quercusbaccarum (Hymenoptera: Cynipidae) on Oak Leaves (Quercus robur) Leszek Stanisław Jankiewicz et al. Insects 2021, 12, 850.
5) Studies on the common spangle gall of oak I. The developmental history. Hough, J.S. New Phytol. 1953, 52, 149–177.
The spatial distribution of leaf galls of Mikiola fagi and Neuroterus quercusbaccarum in the canopy of a central European mixed forest. C. Kampichler et al. Eur. J. Entomol. 99 : 79-84 ; 2002