L’échinococcose alvéolaire, une zoonose émergente
Echinococcus multilocularis
14/12/2021 L’émergence de la COVID 19 a fait surgir dans la sphère publique médiatique un terme savant auparavant souvent inconnu du grand public : les zoonoses (de zoo, animal et nose, maladie) (voir la chronique sur l’exemple du NIPAH). Ce terme désigne des maladies dont l’agent pathogène (bactérie, virus, parasite) peut se transmettre de l’animal à l’Homme et vice versa ; cette transmission peut se faire par contacts directs homme-animal (ce qui s’est probablement passé avec le coronavirus hébergé par une chauve-souris en Chine), par l’intermédiaire de l’environnement (eau, sols), par consommation d’aliments contaminés ou par des arthropodes vecteurs (moustiques, punaises hématophages, tiques, …) ; parfois, ces pathogènes, après mutation, peuvent devenir capables de se transmettre d’homme à homme comme ce serait le cas pour la COVID 19.
Nous avons tendance à associer cette notion avec les pays tropicaux où, certes, sévissent de redoutables maladies épidémiques comme le paludisme, le ZICA ou la bilharziose (voir la chronique sur la limnée) ; nous oublions que dans nos pays tempérés aussi existent des zoonoses endémiques : si le spectre de la rage s’est largement estompé, nous avons d’autres zoonoses toujours bien présentes, voire en expansion, comme la maladie de Lyme ou borréliose transmise par les tiques (voir la chronique) ou l’échinococcose alvéolaire qui sera le sujet de cette chronique. Cette maladie a été identifiée en Europe au 19ème siècle et sévit dans plusieurs pays dont la France. Elle fait de plus en plus parler d’elle pour son caractère très dangereux ; comme l’agent principal de transmission est le renard roux, elle se retrouve au centre de débats et d’enjeux complexes et passionnés avec, comme il se doit, le lot des informations fausses ou déformées.
Ténia
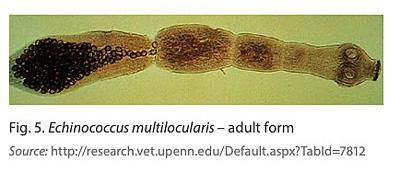
L’agent responsable de cette maladie est un « ver » (terme informel) du groupe des Cestodes : Echinococcus multilocularis. Ce groupe ne renferme que des espèces spécialisées dans la vie parasite à l’intérieur du tube digestif de vertébrés ; avec d’autres groupes eux aussi entièrement parasites comme les Trématodes (voir la chronique sur la limnée), ils font partie du vaste groupe des Plathelminthes, les « vers plats ». Le nom cestode vient du latin cestus, ceinture, qui renvoie à la forme aplatie rubanée de ces vers au corps segmenté et qui s’accrochent à la paroi intestinale grâce à leur tête ronde pourvue de crochets (scolex) et de ventouses. Ils absorbent directement les substances nutritives qui circulent dans l’intestin de leur hôte. Des exemples très connus sont les classiques « vers solitaires » ou ténias, dont le ténia du porc.
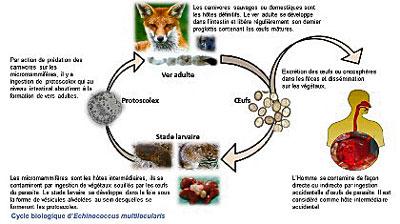
Comme tous les autres cestodes, l’échinocoque, le cestode responsable de l’échinococcose, possède un cycle de vie qualifié de digénique, i.e. qu’il doit passer par deux hôtes successifs, un hôte dit intermédiaire et un hôte définitif, pour assurer sa reproduction. Ces deux hôtes sont liés par une relation prédateur/proie.
Le ver adulte vit dans l’intestin de carnivores sauvages ou domestiques. Long de 2 à 5mm (rien à voir les mètres de longueur des ténias), il se développe entre les villosités intestinales et produit des segments bourrés d’œufs (ou oncosphères) qui se détachent et sont ainsi libérés dans l’environnement via les excréments. Un ver produit environ un millier d’œufs mais un hôte peut héberger des milliers d’individus dans son tube digestif. Le renard roux est l’hôte définitif de loin le plus répandu d’où le surnom populaire de « ténia du renard » attribué à l’échinocoque. D’autres carnivores dont les chiens domestiques (voir la chronique sur le contrôle) peuvent aussi être porteurs. Chez ces animaux, l’installation du parasite ne s’accompagne pas de signes cliniques particuliers et ils peuvent vivre à peu près normalement. On peut détecter la présence de ces vers soit en examinant le contenu du tube digestif sur un animal mort ou via des tests antigènes ou ADN sur des excréments.
Les œufs libérés dans la nature au hasard du dépôt des excréments sur des végétaux doivent ensuite être ingérés par des petits rongeurs, dont les campagnols (les « rats des champs »). Dans leur intestin, les œufs éclosent et libèrent des embryons qui se transforment en larves (métacestodes) ; elles migrent vers le foie et s’y développent sous une forme dite protoscolex non mortelle pour le rongeur (mais ces animaux ont une très courte longévité !). Quand celui-ci est capturé et consommé par un carnivore, ces larves s’installent dans l’intestin et se transforment en adultes. Le cycle est ainsi bouclé.
Et l’homme dans tout ça ?
Pour l’instant, on ne voit pas de rapport avec l’homme dans ce cycle à deux hôtes ? Il se trouve que, comme dans de nombreuses autres zoonoses, ces cycles peuvent connaître ponctuellement des variantes sans issue quand les œufs s’introduisent accidentellement dans l’organisme d’autres animaux ne faisant pas partie du cercle des hôtes définitifs. Justement, si accidentellement (voir ci-dessous les circonstances) par voie orale nous ingérons ces œufs, alors le parasite peut quand même réussir, parfois, à se développer d’une manière inhabituelle sans pouvoir boucler ensuite le reste de son cycle.
Donc, si un œuf arrive dans notre tube digestif, il éclot et donne un jeune stade larvaire (métacestode) qui migre vers le foie (comme chez un rongeur). Là, il forme un petit amas cellulaire (cyste) et développe dans les jours qui suivent une enveloppe protectrice contre nos défenses immunitaires. Une fois installé, il va pouvoir persister ainsi pendant des décennies ! Ce cyste initial reste petit et commence à engendrer des bourgeons externes qui lui restent attachés mais parfois aussi se détachent et forment une masse « à loges multiples » (d’où l’épithète latin multilocularis). Cet amas va se développer de manière continue à une vitesse qui dépend de la force des défenses immunitaires. Cette progression peut s’étaler sur des années sans symptôme avant que des lésions internes du foie ne deviennent apparentes. Dans la plupart des cas, cette période d’incubation dure de 10 à 15 ans (plus rapide chez les personnes immunodéprimées) ; ainsi le diagnostic ne se fait le plus souvent pas avant l’âge de 45-70 ans dans nos pays. Les symptômes liés à l’extension progressive des cystes, tels des métastases cancéreuses, sont des douleurs abdominales, une hypertrophie du foie, une jaunisse et de la fatigue. En fait, cette évolution se rapproche fortement de celle d’un cancer du foie et probablement qu’autrefois on a souvent confondu les deux, faute d’imagerie médicale.
Sans traitement adéquat, la mortalité est de plus de 90% dans les dix ans après l’apparition des symptômes ce qui en fait une maladie redoutable. Le traitement repose sur une ablation partielle de la partie infectée du foie, voire une transplantation totale, et d’un traitement sur deux ans avec un médicament qui provoque de forts effets secondaires.
Transmission
La transmission à l’homme se fait exclusivement par voie orale par ingestion accidentelle directe des œufs via la consommation de végétaux souillées ou, plus rarement, par ingestion des œufs portés par les mains après un contact avec le pelage souillé d’un carnivore porteur.
La première voie des aliments concerne tous les végétaux récoltés près du sol (moins de 50cm de haut) susceptibles d’avoir été souillés par des excréments : salades, pissenlits, légumes du potager, champignons, petits fruits sauvages bas (fraises des bois, myrtilles, …). L’infection par manipulation directe d’excréments de carnivores infectés ne s’applique guère qu’à une poignée de naturalistes cherchant à en analyser les contenus : le port de gants est strictement obligatoire pour ce genre de manipulation à haut risque ! L’autre voie par contact du pelage concerne d’une part les propriétaires de chiens qui peuvent se contaminer de la même manière et d’autre part les chasseurs ou taxidermistes qui manipuleraient à mains nues des renards tués, notamment en les prenant par la queue. Une suggestion toute simple pour limiter cet aléa : interdire le tir des renards et reconnaître enfin le rôle écologique considérable de ce carnivore … mais je rêve !
La grande difficulté avec ce parasite réside dans la résistance extrême de ses œufs ; pour le parasite, ce stade œuf est le seul où il va circuler dehors et l’acquisition d’une résistance extrême a été une adaptation clé dans l’évolution de ces parasites. La dessiccation n’affecte ces œufs qu’à moyen terme : au moins trois mois en été et huit mois en automne-hiver. Le simple lavage des aliments récoltés ne suffit pas, loin s’en faut car ces œufs sont microscopiques (30 microns). La cuisson les détruit à condition d’attendre 70° pendant au moins 5 minutes : donc les aliments consommés crus sont à haut risque ! Au frigidaire à 4°C, les œufs résistent pendant presque … un an et demi ! Congelés à – 18°C, ils tiennent bons pendant neuf mois. Seule une congélation à – 80° pendant trois jours garantit une élimination sûre !
Finalement, on voit bien que dans les zones où le parasite sévit de manière endémique et où on observe une forte prévalence dans les populations de renards, la plus grande prudence sera de mise et certaines activités augmentent nettement les risques (cueillette, jardinage, avoir un chien, chasseurs, forestiers). D’où l’importance de la prévention et des recommandations d’usage dans les zones où la maladie est très présente :
- Une bonne hygiène des mains après la manipulation du pelage de carnivores
- Isoler les jardins potagers par une clôture hermétique et se laver les mains après toute récolte
- Traiter tous les mois les carnivores domestiques susceptibles soit de consommer des rongeurs contaminés ou d’entrer en contact avec les végétaux souillés ou les excréments avec un vermifuge adapté (praziquantel)
- Un dépistage sérologique régulier chez les personnes les plus exposées.
Répartition
Avant de zoomer sur la France, voyons la répartition de cette zoonose à l’échelle planétaire. On ne la trouve que dans l’Hémisphère nord et, pour l’instant, plutôt dans la moitié nord de celui-ci : Europe, Asie et Amérique du nord. A l’échelle planétaire, l’incidence moyenne chez l’homme est de 0,1 pour 100 000 habitants avec les taux moyens les plus élevés en Europe et en Asie. La Chine à elle seule cumule 90% des cas et tout particulièrement le Tibet à cause de l’absence de traitements curatifs. Au Japon, le parasite est très commun chez les renards urbains. Notons que les chiffres sont souvent biaisés dans le sens d’une certaine sous-estimation car le plus souvent cette maladie ne fait pas l’objet de suivi particulier ni de déclaration obligatoire en cas de décès.
En Europe, l’incidence varie de 0,02 à 0,18 cas pour 100 000 personnes. Historiquement, l’échinococcose alvéolaire est endémique dans l’Est de la France, en Suisse, en Allemagne et dans l’ouest de l’Autriche. Mais au cours des dernières décennies, on a commencé à découvrir d’autres pays concernés à des degrés divers vers l’Est et le Nord : pays Baltes, Pologne, Suède, Svalbard, Norvège, Slovénie, … En fait, dans divers pays, c’est la mise en place de protocoles de recherche qui a révélé sa présence alors qu’on la croyait absente. Ainsi en Belgique, une étude conduite en 2008 à partir d’autopsies systématiques de renards tués montre des prévalences chez ce carnivore pouvant atteindre 62% dans certaines régions du pays, … alors que jusque-là on considérait le pays comme à faible risque. En Suisse, pays historiquement concerné et où on dispose de données fiables depuis les années 1950, l’incidence annuelle de la maladie chez les humains a presque doublé au début des années 2000. Deux explications possibles sont avancées par rapport à cette évolution générale : la disparition de la rage suite aux campagnes de vaccination alors que cette maladie imposait auparavant une forte mortalité ; la tendance croissante au développement de populations urbaines de renards avec de fortes densités, un processus entamé depuis la fin des années 90 qui augmente considérablement les risques de contact avec les humains dans de telles zones à haute densités humaines.
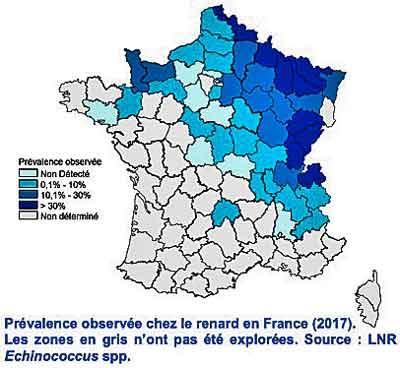
Et en France ? Historiquement, le quart Nord-Est du pays est concerné par cette zoonose et jusqu’à la fin des années 90, seulement quinze départements de ce secteur (plus deux en Auvergne) étaient touchés. Ceci explique entre autres que le réseau de surveillance France Echino soit coordonné par le CHRU de Besançon en Franche-Comté. De 1982 à 2018, 776 cas ont été recensés en France et cinq départements concentrent 60% cas : Doubs, Jura, Vosges Haute Saône, Haute Savoie. Cependant, on observe une certaine augmentation continue du nombre de cas par an : entre 2001 et 2006, la moyenne était de 17,2 par an ; pour 2006-2012 on passe à 30,8 et 35,8 pour 2013-2018 !
Depuis 1997, de nouveaux cas d’échinococcose humaine ont été observés dans des départements où le parasite n’était pas connu sur les renards locaux : Ain, Allier, Aveyron, Côte d’Or, Creuse, Nord entre autres, bien en avant de la zone historique. De ce fait, une étude exhaustive a été conduite entre 2005 et 2010 sur une zone élargie à 44 départements à partir de l’Est : plus de 3300 renards tués ont été analysés. L’étude confirme la présence de la maladie dans 25 nouveaux départements avec une prévalence moyenne chez les renards de 17% mais pouvant atteindre 54% pour certains départements et encore plus sur des secteurs limités. Des cas humains signalés en dehors de la zone historique (comme dans la Manche ou le Calvados) confirment cette nette expansion vers l’Ouest et le Sud. Les chercheurs penchent pour une expansion récente réelle plutôt que d’invoquer la non-détection antérieure. Et encore, dans cette étude, les zones urbanisées sont de facto sous-évaluées car la chasse n’y sévit pas et on ne dispose donc que de peu d’échantillons. Néanmoins, pour l’instant, les prévalences mesurées chez les renards urbains en Allemagne par exemple indiquent un taux de contamination bien plus faible qu’en milieu rural.
L’autre échinococcose
Il existe une autre échinococcose susceptible d’affecter l’homme : l’échinococcose uniloculaire ou cystique, dite encore hydatidose. Le responsable est une autre espèce proche E. granulosus qui est en fait un complexe de plusieurs espèces jumelles très proches. L’hôte définitif est le plus souvent le chien et les hôtes intermédiaires sont des animaux domestiques tels que moutons ou porcs. Là aussi, par ingestion accidentelle, la maladie peut atteindre l’homme et se manifeste par la formation d’un kyste, le plus souvent au niveau du foie mais aussi au niveau des poumons. Là aussi, la croissance est très longue mais la mortalité est bien moindre puisque seulement 2 à 4% des personnes infectées en meurent. L’une des voies principales de contamination des chiens repose sur l’usage d’abats crus pour nourrir les chiens à la campagne. Chez les animaux contaminés, que ce soit les chiens ou le bétail, le parasite ne provoque pas de désordres majeurs ; par contre, pour le bétail, après abattage, toute carcasse trouvée porteuse du parasite est rejetée ce qui entraîne des coûts économiques importants là où la maladie prévaut.
Donc, en dépit de sa faible incidence absolue en nombre de décès imputables, l’échinococcose alvéolaire reste un problème sanitaire préoccupant quand on voit se dessiner les tendances d’expansion générale. On la classe désormais parmi les maladies dites émergentes i.e. une maladie dont l’incidence réelle augmente de manière significative dans une population donnée d’une région donnée et pendant une période donnée par rapport à la situation épidémiologique habituelle de cette maladie.
Alors quelles stratégies adopter pour affronter cette émergence ? En France, le devant de la scène est occupé par les « régulateurs de la faune sauvage » avec une doctrine simpliste, devenue religion d’état pour des raisons électoralistes : la destruction directe systématisée des renards (y compris avec des pratiques barbares comme le gazage des terriers) sans aucune réflexion sur son intérêt, son efficacité ni sur les conséquences écologiques (régulation des populations de rongeurs). L’extension de l’échinococcose devient dans ce contexte un argument fallacieux de plus pour justifier une pratique destinée en fait seulement à protéger le gibier d’élevage libéré massivement à la veille de l’ouverture de la chasse. Quelles sont donc les alternatives à cette voie sans issue et qui, de toutes façons, réunit contre elle de plus en plus de personnes d’un simple point de vue éthique et moral ? Nous consacrons une autre chronique aux solutions possibles pour affronter ce problème sanitaire de manière durable et responsable.
Bibliographie
Fiche de description de danger biologique transmissible par les aliments : Echinococcus multilocularis
Saisine n°2016-SA-0274 Mise à jour : Avril 2020 ANSES
Site CNR Échinococcoses https://cnr-echinococcoses-ccoms.univ-fcomte.fr
L’Echinococcose alvéolaire, une zoonose émergente en Wallonie. Une approche « one health » par le groupe ECHINO-LIEGE. Audrey Cambier et al. VETERINARIA n°1 2018
Echinococcus granulosus sensu lato and Echinococcus multilocularis: A review Ian David Woolsey et al. Research in Veterinary Science Volume 135, March 2021, Pages 517-522
Westward Spread of Echinococcus multilocularis in Foxes, France, 2005–2010. Benoît Combes et al. Emerging Infectious Diseases Vol. 18, No. 12, 2012
Fox defecation behaviour in relation to spatial distribution of voles in an urbanised area: An increasing risk of transmission of Echinococcus multilocularis? E. Robardet et al. International Journal for Parasitology (2010)
Control Strategy for Echinococcus multilocularis Daniel Hegglin and Peter Deplazes Emerging Infectious Diseases Vol. 14, No. 10, 2008