Les ululements de la hulotte
Strix aluco
17/02/2022 Elle est la voix de la nuit des bois et des campagnes, la marque des paysages sonores nocturnes : la chouette hulotte ou, pour les familiers, la hulotte ! Elle reste la seule chouette encore assez commune dans la plupart des milieux avec un minimum d’arbres, y compris jusqu’au cœur des grandes villes. Ses ululements portent loin et sont assez faciles à imiter même sans être très doué en la matière ; ceci lui a valu le surnom (entre autres) très populaire de chat-huant (voir la chronique De chouettes mots). Ces vocalisations intéressent fortement les ornithologues du fait de leur relative simplicité et de la bonne réactivité de la hulotte à la pratique de la repasse, i.e. diffuser un chant enregistré pour déclencher une réponse de la part d’une hulotte cantonnée (voir la chronique sur le chant de la huppe à propos de cette méthode) ; en plus, cette espèce est très territoriale et occupe son territoire toute l’année. L’abondante bibliographie qui accompagne cette chronique témoigne de cet engouement pour les hulottes.
Trois notes
Le répertoire vocal des hulottes, comme celui des autres rapaces nocturnes (les strigiformes : voir la chronique générale sur ce groupe), est assez limité ce qui n’exclut une très forte diversité dans les détails. Les mâles peuvent ululer, autrement dit chanter, toute l’année mais avec deux pics d’activité intense : au printemps en début de nidification et en automne-début d’hiver avec la re-délimitation des territoires conservés toute l’année. Le mâle, installé en général sur un perchoir élevé, émet son chant en deux temps : une première note, un ouuu prolongé d’introduction (que nous noterons U1 pour la suite), puis un court silence (S1) d’une à deux secondes, suivi d’un trémolo prolongé à sonorité d’ocarina qui finit en vibrato (U2) : oûû.. ououououuuuuu, avec une première note détachée des suivantes. Suit un silence plus ou moins long (S2) avant de recommencer éventuellement un nouveau chant. Parfois, les mâles émettent une version plus rêche et moins « mélodieuse » notamment quand ils sont confrontés à une repasse. On signale aussi pendant les parades (où le mâle apporte des proies à la femelle) une variante sous forme de longs trilles. Les analyses des sonogrammes (enregistrements) montrent que la fréquence de ces notes se situe bien en-dessous de 1 kHz et que l’amplitude sonore peut quand même atteindre 90 dB ! Ceci explique la très grande portée de ce chant que l’oreille humaine peut percevoir jusqu’à presque 1km par temps calme (et sans pollution sonore ambiante !).
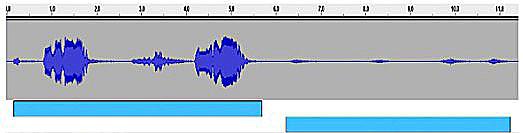
Contrairement à la majorité des oiseaux, la femelle peut aussi ululer comme le mâle ; ceci n’est pas très surprenant compte tenu de la très forte territorialité des hulottes où le couple défend agressivement le territoire contre les intrus ; de plus, comme les autres rapaces nocturnes, il n’y a pas de dimorphisme sexuel, i.e. pas de différences de coloration de plumage entre les deux sexes. Les chants des femelles sont souvent émis en duos avec les mâles lors de conflits avec des voisins notamment au moment de la délimitation des territoires en automne. D’ailleurs, elle réagit elle aussi à la repasse du chant en s’approchant du haut-parleur, avec des ululements et des cris miaulés et des simulacres d’attaques et des vols circulaires au-dessus de l’émetteur. Par contre, le chant des femelles se compose de 4 notes en plus rauques que celles du mâle ; la structure différente de l’appareil vocal explique sans doute cette différence.
En dehors de ces ululements, on note des cris de contact très doux quit ; les femelles se signalent par des ki wik sur deux notes, puissants, très sonores et répétés en séries. Enfin, les jeunes non volants réclament la nourriture par des cris étouffés tchiit, simples ou doubles.
Comme pour la huppe (voir la chronique), nous vous proposons d’aller écouter le chant et les cris des hulottes sur le site Xeno-canto où des centaines d’exemples sont disponibles.
Activité fluctuante
Pour cette espèce sédentaire et territoriale, l’activité vocale liée à la reproduction et au territoire peut s’exprimer toute l’année mais avec bien entendu de nombreuses variations possibles comme le montrent diverses études. Sur la période quotidienne, on peut distinguer les chants du crépuscule entre 17H et minuit et les chants de l’aube entre minuit et 6H. Une étude fine à partir d’enregistrements montre qu’en moyenne la seconde note U2 (voir ci-dessus) est plus longue que la première U1 (en moyenne 1,36 secondes contre 1,08 secondes) ; mais U1 est plus courte dans les chants de l’aube que dans ceux du crépuscule alors que U2 ne varie pas. De plus, dans les chants de l’aube, on note un plus grand espacement (S2) entre deux chants. De même, selon la saison, on observe que cet espacement augmente en été par rapport au printemps. Ces premières données pointent la grande plasticité de ce chant en apparence « primaire » et simpliste mais susceptible donc d’être fortement modulé.
Dans le nord de l’Espagne, des ornithologues ont suivi des hulottes par radio-tracking en les enregistrant ainsi que leurs compagnes ou compagnons et leurs voisins immédiats ; ils ont ainsi collecté près de 8800 enregistrements sur une longue période. Ils ont pu ainsi dégager des facteurs de variation : le sexe avec les mâles qui chantent nettement plus que les femelles ; la période du cycle annuel avec un pic d’activité au moment de l’incubation (quand la femelle couve les œufs dans la cavité du nid) et en automne ; et la météo avec la pluie et le vent qui diminuent sensiblement l’activité. Ils concluent qu’en effectuant des suivis d’écoute pendant la période d’incubation au printemps et par temps favorable (calme et sec), on ne détecte que 12% de la population d’un secteur inventorié !
Face à un rendement aussi faible, les scientifiques qui veulent évaluer la taille de populations sur des secteurs délimités ont recours à la technique de la repasse. Elle a été testée sur une vaste zone boisée en Slovénie et le protocole le plus efficace permettant de détecter 90% de la population en deux passages semble être l’alternance d’une repasse pendant 10 minutes du chant de l’espèce puis 5 minutes d’écoute silencieuse pour repérer les réponses.
Variations individuelles
Dans une étude menée en Grande-Bretagne dans trois régions différentes, on a montré que chaque individu enregistré différait sensiblement de tous les autres en prenant en compte divers paramètres sonores : pour 5 paramètres sur 13, on observe des variations. Parmi les variations dominantes figurent la durée moyenne de U2 (voir ci-dessus), l’amplitude de la modulation et la fréquence de U1. Autrement dit, chaque hulotte a sa propre « griffe sonore » et on peut parler de races microgéographiques. Il y a des différences significatives selon les habitats notamment : ainsi les hulottes des bois n’ont pas tout à fait le même chant que celles des zones agricoles ouvertes avec une fréquence plus haute dans ces dernières ; pour autant, les différences observées ne vont pas dans le sens d’une transmission à plus grande distance en milieu boisé. Tout ceci suggère donc l’existence, comme certains passereaux de dialectes qui seraient transmis par écoute des congénères (culturellement). Comme les chants de hulottes aux territoires contigus ne se ressemblent pas plus que ceux de hulottes non en contact, on peut penser que si apprentissage il y a, il doit se faire après la dispersion des jeunes émancipés.
Les voisins
Compte tenu de ce qui précède, on peut se demander si, entre elles, les hulottes se reconnaissent. En Italie, on a testé douze mâles et leurs femelles installés sur des territoires dans la banlieue de Pavie avec la méthode de la repasse ; on leur envoie soit un enregistrement d’un mâle proche, soit celui d’un mâle enregistré dans une autre région. La réaction agressive est bien plus forte quand il s’agit de voisins et les hulottes des deux sexes adoptent alors un comportement et un type de voix bien plus élevés qu’envers des mâles « étrangers ».
Dans leur environnement, les hulottes peuvent être amenées à côtoyer d’autres rapaces nocturnes ; chaque espèce possède des vocalisations spécifiques mais néanmoins on constate une certaine convergence (sans doute imposée par la vie nocturne) dans les tonalités et structures. Ainsi, les hulottes réagissent à la repasse d’autres espèces qu’elles côtoient comme par exemple la nyctale de Tengmalm dans les zones boisées montagnardes et au chant ressemblant vaguement à celui de la hulotte. Mais, dans l’étude menée en Slovénie (voir ci-dessus), la repasse de chants d’autres espèces suscite un taux de réponses des hulottes bien moindre que la repasse de chants de hulottes. La réaction correspond peut-être à une certaine compétition même si les niches écologiques occupées diffèrent nettement.
Et puis, il peut y avoir très localement un autre type de voisin très encombrant : le grand-duc d’Europe (voir la chronique), un super-prédateur qui chasse volontiers les rapaces nocturnes de taille inférieure dont les hulottes (aussi les hiboux moyen-ducs). Comme il pratique la chasse à l’affût depuis un perchoir, il doit les localiser à leurs vocalisations. Une étude a été conduite en Andalousie dans un secteur où les hulottes côtoient des grands-ducs. On constate que le nombre de chants émis baisse chez les mâles de hulottes vivant sur des territoires de grands-ducs chanteurs (et qu’elles peuvent donc entendre de très loin). Les hulottes semblent donc ajuster leur comportement vocal pour minimiser les risques liés à la présence d’un prédateur dangereux ; néanmoins, plus il y a de mâles cantonnés autour d’un mâle de hulotte donné, plus il va chanter relativement. Il y a donc un compromis bénéfice (défendre son territoire) / risque (être capturé).
Signal honnête
Comme chez les autres oiseaux, le chant peut avoir plusieurs fonctions : repousser les autres mâles qui s’aventurent sur le territoire ; attirer une femelle pour constituer un couple ; stimuler la femelle pour inciter à la reproduction. Dans les tests à la repasse, le rythme et la puissance sonore du chant sont liés à l’agressivité de la réponse mais pas à la qualité du territoire (richesse en proies et en cavités pour nicher). Par contre, la durée et la gamme de fréquences sont liées au succès de la reproduction et à la stabilité du territoire : ces deux paramètres reflètent donc le potentiel compétitif du mâle, i.e. sa qualité de défenseur du territoire du couple ; ils signalent sans doute les meilleurs territoires tant en termes de ressources que performances du propriétaire. Quand un mâle en couple se trouve impliqué dans une querelle territoriale avec un mâle voisin ou un individu célibataire qui cherche à se fixer, il cesse d’ululer quand sa femelle le rejoint et participe activement à la défense : le chant ne sert donc pas à « garder » la femelle.
Dans une étude anglaise, on a effectué sur des hulottes suivies par radio-tracking des prélèvements sanguins qui permettent d’évaluer la charge parasitaire et donc l’état de santé général ; ensuite, on les teste à la repasse. La fréquence sonore et la gamme de fréquences utilisées sont moins élevées chez les mâles avec une forte charge parasitaire : les femelles disposent donc a priori (si elles sont capables de l’apprécier) d’un moyen d’évaluer la qualité du mâle chanteur !
Les femelles disposent d’autres moyens d’évaluer la qualité du mâle lors des parades où les mâles leur apportent des proies : selon la quantité de nourriture et sa qualité, elles peuvent évaluer l’habileté du mâle à chasser mais aussi la qualité du territoire (richesse en proies) ; cette habileté du mâle s’améliore avec l’âge et le temps de résidence sur un même territoire : plus il le connaît, plus il sait où chasser. Cependant, ces offrandes ont lieu après la formation du couple : les ululements pourraient donc servir de signal initial de qualité en amont. Tout ce système s’inscrit dans le cadre d’un comportement fortement monogame et avec des couples durables ; les cas de mâles bigames, peu nombreux (3 sur 22 dans une étude italienne) concernent des mâles qui annexent un territoire voisin et la femelle dont le mâle est mort.
So british
Terminons cette chronique avec une histoire typiquement anglaise ! Du fait de leur insularité, les ornithologues anglais ont souvent « l’obsession » de chercher à démontrer que les populations des espèces vivant sur leur île ont évolué en sous-espèces distinctes de celles résidant sur le continent voisin, voire même en espèces distinctes ! La hulotte n’échappe pas à cette traque. Ainsi, il semblerait que les hulottes anglaises se distinguent par un trait de comportement surprenant : l’émission régulière de chants en plein jour. Depuis 2013, on a ainsi collecté plus de 500 observations de hulottes chantant en plein jour avec un pic autour de midi ! Ailleurs sur le continent, on écoute très rarement des hulottes chanter ainsi en plein jour ; aux Pays-Bas, en Belgique et en Hongrie, on a des observations mais bien loin de la fréquence observée en Grande-Bretagne. De plus, les observations montrent que les chants diurnes de hulottes britanniques se manifestent encore plus souvent par temps ensoleillé. Ce comportement différentiel serait peut-être en expansion tout en restant malgré tout encore marginal. Peut-être s’agit-il d’un effet non expliqué du changement climatique ? … ou de la tendance des hulottes à habiter des milieux urbains ou péri-urbains où elles ont plus de chances d’être contactées ? … ou tout simplement d’un biais procédural à cause du très grand nombre d’observateurs des oiseaux en Grande-Bretagne qui arrivent ainsi à détecter un phénomène rare de nature ? A suivre donc pour savoir si la hulotte anglaise ne va pas devenir … diurne et une nouvelle espèce en devenir : Strix brittanicus ?
NB : les photos qui illustrent cette chronique ont été prises en plein jour avec une hulotte immobile perchée sur un mur de mon village (sans doute malade ?) ; merci à G. Peyrin qui me l’avait signalée.
Bibliographie
Daily and seasonal fluctuation in Tawny Owl vocalization timing. Agostino PV, Lusk NA, Meck WH, Golombek DA, Peryer G (2020) PLoS ONE 15(4): e0231591
Factors affecting spontaneous vocal activity of Tawny Owls Strix aluco and implications for surveying large areas INIGO ZUBEROGOITIA et al. Ibis (2018)
Territory monitoring of Tawny Owls Strix aluco using playback calls is a reliable population monitoring method, Al Vrezec & Irena Bertoncelj (2018) Bird Study, 65:sup1, S52- S62,
Macro and microgeographical variations in the ‘hoot’ of Italian and English tawny owls (Strix aluco) , Paolo R. Galeotti , Bridget M. Appleby & Steven M. Redpath (1996) Italian Journal of Zoology, 63:1, 57-64,
Variation in the male territorial hoot of the Tawny Owl Strix aluco in three English populations. B. M. APPLEBY & S. M. REDPATH Ibis 2008
Differential responses of territorial Tawny Owls Strix aluco to the hooting of neighbours and strangers. Gianni Pavan. Ibis 135 : 300-304 1993
Tawny owl vocal activity is constrained by predation risk. Rui Lourenço et al. Journal of Avian Biology 44: 461–468, 2013
Correlates of Hoot Rate and Structure in Male Tawny Owls Strix aluco: Implications for Male Rivalry and Female Mate Choice Paolo Galeotti Journal of Avian Biology, Vol. 29, No. 1. (Mar., 1998), pp. 25-32.
Do male hoots betray parasite loads in Tawny Owls? Stephen M. Redpath, Bridget M. Appleby and Steve J. Petty JOURNAL OF AVIAN BIOLOGY 31: 457–462. 2000
The changing face of Britain’s Tawny Owls Jeff R. Martin and Heimo Mikkola August 2014 British Wildlife



