Polypore marginé : corne d’abondance de biodiversité
Fomitopsis pinicola
16/03/2021 Parmi les innombrables champignons décomposeurs du bois mort en forêt (voir la chronique sur ce sujet général), les polypores retiennent l’attention de par leur taille souvent conséquente, leur consistance massive et ligneuse et leur développement directement sur le bois mort ou sur les arbres en cours de dépérissement (voir les exemples du polypore du bouleau ou du polypore soufré). Le polypore marginé figure parmi les espèces les plus communes. Ses grosses « fructifications » accrochent tout de suite le regard grâce à leurs couleurs vives : en groupes, ils composent des scènes bigarrées avec une grande force esthétique même au cœur de l’hiver. Au-delà de leur rôle majeur dans la décomposition du bois mort, leur taille, leur longévité et leur abondance en font un micro-habitat (voir la chronique sur cette notion) unique et original du bois mort : ils hébergent une incroyable biodiversité animale au fil de leur vie qui prolonge celle du bois en décomposition.
Les mots justes

Carpophore vu de dessous : la couche fertile ou hyménium blanche 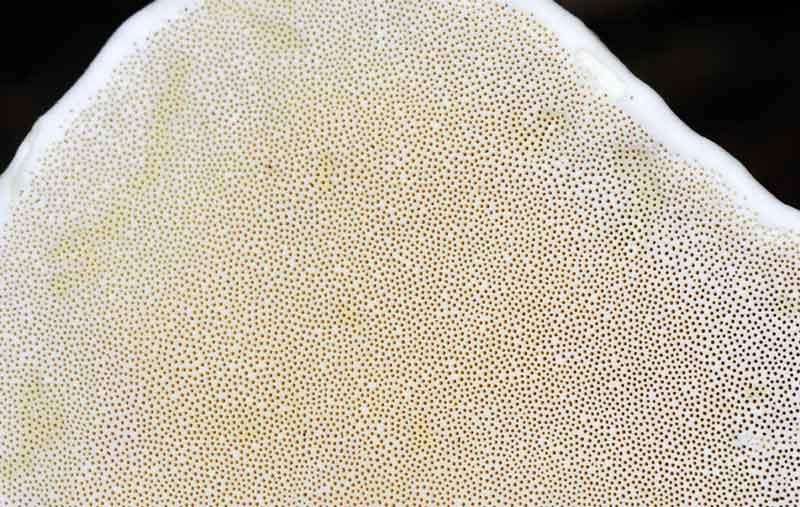
Des milliers de pores par où sortent les spores
Avant de décrire cette espèce, il convient de préciser deux termes. D’une part, l’appellation polypore attachée à cette espèce fait référence à la surface fertile des « fructifications », formée d’une multitude de pores serrés et soudés entre eux (poly = plusieurs) par où vont s’échapper les spores servant à la reproduction. Ce nom de polypore ne devrait rigoureusement s’appliquer qu’aux seules espèces du genre Polyporus dont ne fait pas partie le polypore marginé (genre Fomitopsis). L’usage populaire et même parmi les mycologues a étendu l’emploi de ce terme à un vaste groupe d’espèces ayant la même apparence avec des fructifications dures fixées sur le bois mort et une surface fertile à pores. Ces espèces n’ont vraiment en commun que le fait d’être classées toutes dans l’ordre des Polyporales qui inclut par ailleurs de nombreuses autres formes très différentes dont des champignons en forme de croûtes.

Carpophore en forme de sabot de l’amadouvier 
Amadouvier 
Carpophore très ligneux du phellin du chêne 
Carpophores charnus de polypore hérissé sur frêne
Second mot problématique, « fructifications », utilisé pour désigner ces champignons tels que nous les voyons. Pour les scientifiques, le terme de fruit est indissociable de celui de plantes à fleurs (angiospermes) puisqu’un fruit résulte de la transformation d’une fleur fécondée. Là encore, l’usage populaire a étendu cette notion, en la tempérant néanmoins avec le terme de fructification, à tous les organes reproducteurs des autres groupes végétaux comme par exemple chez les mousses … sauf que les champignons ne sont pas des végétaux (voir la chronique sur les lichens) ! Les mycologues utilisent plutôt les termes de carpophore (mais étymologiquement, ce mot signifie phore = qui porte et carpo = fruit !) ou sporocarpe, un peu plus juste (« fruit qui porte les spores »). En tout cas, il s’agit bien de l’organe producteur de spores. Mais, ce que nous nommons « le » champignon ne correspond en fait qu’à la partie émergée d’un énorme iceberg : un réseau de filaments ou mycélium infiltré dans le bois mort qu’il décompose. Et ce mycélium caché peut (ou pas) produire à un moment de son développement des organes reproducteurs externes, « les » champignons. Autrement dit, quand on observe une colonie de polypores installée sur un tronc mort, il faut se dire qu’à l’intérieur de celui-ci se tient une masse de filaments bien plus volumineuse que l’ensemble des carpophores ; et, inversement, un tronc mort peut être complètement envahi par un mycélium de polypore sans qu’on ne le voit extérieurement s’il ne produit pas de carpophores !
Tricolore
Le polypore marginé reste assez facile à identifier, un détail important dans ce groupe très complexe, même si, comme les autres polypores, il présente une extrême variabilité d’apparence. Le gros chapeau en forme de sabot ou de console irrégulièrement bosselée dessus rappelle celui des très proches amadouviers. Il peut atteindre jusqu’à 40cm de diamètre avec une moyenne autour de 10-20cm et jusqu’à 20cm d’épaisseur. Trois couleurs bien tranchées (le plus souvent !) s’affichent sur ce chapeau : une marge claire en forme de bourrelet (d’où l’adjectif marginé), une partie centrale jaune à rouge orangé très voyante et la partie basale par laquelle il se fixe au support grise à noire. A partir de celle-ci se développe au fil du vieillissement une croûte vernissée noirâtre qui peut finir par recouvrir presque entièrement le chapeau et l’assombrit ce qui masque en grande partie la belle couleur orangée. Ce revêtement présente la particularité de fondre à la chaleur, révélant alors sa nature résineuse, ou de se dissoudre si on frotte avec de l’alcool.

Carpophore « multiple » 
Par temps humide, l’aspect tricolore ressort nettement 
Carpophore âgé où la teinte noire s’étend 
La marge blanche contraste avec la bande orange
Le dessous, nettement aplati contraste vivement par son uniforme teinte blanc crème et son réseau très dense de pores ronds de 2 à 3mm de diamètre. En coupe, on découvre la chair blanche, assez dure avec la consistance du liège, répand une douce odeur agréable. Il y a plusieurs couches superposées de tissus fertiles (hyménium) à pores. Par la couche la plus externe les spores s’échappent à certaines périodes favorables par centaines de millions : elles enduisent l’environnement immédiat d’une poudre blanche ; on parle de sporée. Comme ces champignons restent actifs plusieurs années (on cite des records de près de 40 ans !) une fois à maturité, chaque carpophore doit libérer des milliards de spores, dispersées essentiellement par le vent.
Les jeunes sujets ont une forme bien moins typée, souvent en boule, et leurs chapeaux sont le plus souvent seulement bicolores, la couleur noire basale n’apparaissant que dans un second temps. Au printemps, alors qu’ils sont en pleine activité de croissance active, leur hyménium laisse échapper de grosses gouttelettes liquides qui s’alignent sur la marge du chapeau ; il paraît que les abeilles récoltent ce liquide.

Jeune carpophore sans la couleur noire basale 
Emergence de futurs carpophores sur la coupe de ce conifère déjà investi sur les flancs
Décomposeur
Le polypore marginé se comporte avant tout en décomposeur de bois mort (saprophyte) mais il peut aussi s’attaquer à des arbres encore vivants mais malades ou très affaiblis et devient alors parasite. Il colonise très rapidement les arbres blessés ou fraîchement tués suite à une attaque de scolytes, ces petits coléoptères qui creusent des galeries sous les écorces des arbres en fin de vie : dans l’année qui suit la mort de l’arbre, il peut s’installer et rapidement il va produire des carpophores tout au long de l’année selon les conditions météorologiques. Il colonise les troncs des arbres encore sur pied, les grosses branches ou troncs tombés au sol ou découpés et laissés sur place, sans oublier les souches (voir la chronique sur ce sujet).

Sur les grosses racines d’une souche de sapin pectiné abattu 
Situation rare : sur une « petite » branche !
On le trouve aussi bien sur les feuillus que sur les résineux même s’il semble plus commun sur ces derniers (d’où l’épithète latin pinicola = qui aime les pins) ; il a été noté sur 82 espèces d’arbres à bois tendre et 42 espèces à bois dur et dense ce qui en dit long sur son caractère généraliste. Les essences sur lesquelles on le rencontre le plus souvent sont : pour les résineux, le pin sylvestre, l’épicéa, le pin sylvestre ou le sapin pectiné ; pour les feuillus : le hêtre, l’aulne glutineux, le cerisier sauvage ou merisier, le peuplier tremble, … Dans les forêts boréales anciennes de Scandinavie dominées par des résineux, on a relevé des densités de 3000 carpophores par hectare !
Cet éclectisme interroge quand on sait les différences importantes de composition du bois selon les essences. Globalement, on constate qu’il décompose plus vite le bois des essences à croissance rapide (et donc à bois très tendre) par rapport à celles à croissance lente au bois plus dense et dur. La différence entre bois tient avant tout à leur richesse relative en lignine, un composé très résistant à la décomposition et qui durcit les cellules ligneuses. Ainsi le bois des résineux comme le pin sylvestre et l’épicéa commun renferme 27 à 30% de lignine contre à peine 20% chez le peuplier tremble. On a étudié le fonctionnement physiologique du polypore marginé en le cultivant sur ces trois bois : on a découvert qu’il peut modifier l’expression des gènes qui pilotent la synthèse des enzymes intervenant dans la décomposition du bois selon l’essence attaquée et selon l’avancée de la décomposition pour un arbre donné. Autrement dit, le polypore marginé adapte son arsenal chimique selon le contexte !

Sur un hêtre 
Sur un bouleau
Cubique
L’activité intense du polypore marginé modifie rapidement l’aspect du bois sur lequel il se nourrit. Son équipement en enzymes ne lui permet pas de décomposer efficacement la lignine mais essentiellement la cellulose et les hémicelluloses, autres composants majeurs du bois. Ainsi, au fur et à mesure que les filaments du mycélium se propagent dans la masse du bois, ces derniers composés sont détruits ce qui diminue rapidement la densité et la résistance de celui-ci. Comme la lignine persiste, le bois vire au brun car la couleur de la lignine devient dominante sur celle plus claire des celluloses ; de plus, il tend à se dessécher et se fissure selon des fentes transversales et parallèles au sens des fibres du bois. Il devient très friable, presque pulvérulent et s’émiette en petits cubes faciles à détacher. On parle donc de pourriture brune cubique ; elle s’oppose à la pourriture blanche, causée par d’autres espèces de champignons mangeurs de bois : ceux-ci décomposent la lignine et la cellulose et le bois blanchit et se détache en fibres molles. Le polypore marginé n’est pas le seul champignon capable de provoquer ce type de pourriture brune : l’amadouvier, le polypore soufré (voir la chronique), la fistuline hépatique le font aussi et bien d’autres.

Tronc de pin en phase finale de décomposition par la pourriture cubique 
Le bois devenu brun foncé se fragmente en petit cubes 
De ce tronc de conifère, il ne reste qu’un squelette central imprégné de lignine : noter tous les débris tombés au sol
Son activité, en libérant notamment des substances telles que de l’oxalate, acidifie fortement le bois mais il se montre quasi insensible à cette acidification qui lui confère une certaine supériorité dans la compétition avec les autres espèces de polypores mangeurs de bois. Ainsi, il réussit à remplacer les espèces responsables de la pourriture blanche déjà installés sur un arbre mort. Cette suprématie relative modifie donc l’évolution des troncs entamés : au final, ils se transforment en squelettes décharnés très résistants (le cœur imprégné de lignine), complètement secs dont la décomposition finale se trouve ainsi repoussée de plusieurs décennies. Avec la généralisation des épisodes de mortalité massive d’arbres suite aux vagues de sécheresse successives, on se demande si cette supériorité du polypore marginé ne va pas repousser la transformation finale du bois mort en éléments minéraux (minéralisation), étape cruciale pour la formation et le maintien de la qualité nutritive des sols forestiers !
Néanmoins, sur les troncs et bûches en phase médiane de décomposition, on constate une certaine diversité augmentée en espèces quand le polypore marginé est présent et tant qu’il n’occupe pas entièrement le substrat ; son activité favorise peut-être dans un premier temps l’installation d’autres espèces à pourriture brune.
Deuxième vie
Ces carpophores volumineux et charnus constituent autant d’habitats uniques à la fois comme abri et comme source de nourriture pour une grande diversité d’arthropodes (insectes, acariens, …) avec surtout des coléoptères plus ou moins spécialisés qui relèvent du vaste groupe écologique des saproxyliques, i.e. des espèces qui vivent aux dépens du bois mort et de ses annexes. Une étude menée par exemple dans le sud de la Norvège, dans une forêt d’épicéas (pessière) de 200 hectares a recensé pas moins de 36 espèces différentes de coléoptères dans les carpophores du polypore marginé dont 6 espèces inscrites sur liste rouge (espèces menacées ou en déclin) ; les scientifiques estiment que le nombre réel doit avoisiner les 60 espèces pour ce seul micro-habitat ! En cela, on peut donc dire que les polypores apportent un bonus majeur de biodiversité à l’arbre mort en plus des espèces qui colonisent directement le bois mort. Plus la quantité de bois mort dans une forêt est élevée, plus il y a de chances que des polypores s’installent et plus la diversité des coléoptères colonisateurs dits fongicoles sera élevée avec une augmentation du nombre d’espèces rares. La taille des carpophores importe aussi évidemment : plus ils sont volumineux et plus ils ont des chances d’héberger plus d’espèces et plus longtemps.
Décomposition
Cette diversité s’explique en grande partie parce que ces champignons vont connaître eux-mêmes, comme leur nourriture le bois mort, un processus de décomposition après leur mort. Comme les autres grands polypores ligneux, ils passent par une série de cinq stades successifs. Le stade I correspond à l’émergence des jeunes carpophores qui commencent à grandir et à développer sous leur chapeau un hyménium fertile ; à ce stade, ils ne sont généralement pas attaqués. Ils entrent dans le stade II à maturité avec le début de la production intense de spores ; cette manne considérable et très nutritive attire des coléoptères ultraspécialisés dans la consommation des spores microscopiques dont un sous-groupe de la famille des Ptilliidés, les coléoptères aux ailes frangées, qui sont les plus petits coléoptères au monde ! Longs de 0,3 à 0,6mm, de forme étroite, ils vivent dans les pores, à la source des spores. Initialement, on ne connaissait ce groupe que du Nouveau Monde mais on en a découvert récemment dans des amadouviers en Suède : ils font partie de cette vaste biodiversité qui reste encore à inventorier même en Europe ! A ce stade s’installent aussi des acariens et des asticots de mouches fongivores qui attirent des prédateurs en grand nombre. Plus de la moitié des carpophores de polypore marginé d’une forêt peuvent ainsi être colonisées par ce réseau trophique. Certains prédateurs chassent en surface sur l’hyménium comme une espèce de staphylin, Gyrophaena boleti, inféodée aux carpophores de cette espèce de polypore ! Il possède des brosses à spores au bout des pièces buccales (maxilles).

A la mort du champignon à partir d’une dizaine d’années, on entre dans le stade III. Des petits coléoptères de la famille des vrillettes (Anobiidés) creusent des galeries ; c’est le moment où arrivent massivement des espèces de la famille de Ciidés, spécialisée dans la colonisation des polypores ; plus de 500 espèces de petite taille sont connues dans le monde, toutes avec ce mode de vie qualifié de mycétophage (mangeurs de champignons) aussi bien au stade larve qu’adulte. Chez nous, une espèce commune Cis glabratus domine souvent très fortement dans les carpophores en début de décomposition. Des chenilles de mites, des acariens venus de la litière du sol et bien d’autres colonisent alors ces polypores. Puis le caropophore entre en décomposition (stade IV) ; selon qu’il reste sec ou humide (en fonction de sa situation), de nouveaux assemblages différents d’espèces vont s’installer ; des trous apparaissent et l’intérieur se creuse. On atteint ainsi le stade V où le champignon vidé de sa substance finit par tomber au sol.
Par ailleurs, il existe aussi des espèces spécialisées dans la consommation du mycélium qui produit ces carpophores ; ainsi en France, vit une espèce de coléoptère très rare (connue seulement de 12 départements en très petites populations dans des forêts anciennes), Peltis grossa (famille des Trogossitidés), proche des silphes : il a spécifiquement besoin de bois mort attaqué par le polypore marginé dans lequel il consomme le mycélium à l’intérieur du bois, près des émergences des carpophores.
Attraction
Si ces carpophores sont des habitats intéressants, ils n’en présentent pas moins un inconvénient majeur pour les insectes : leur extrême dispersion dans l’environnement et le caractère imprévisible de leur apparition. Les espèces de coléoptères fongicoles doivent donc les localiser comme des îlots perdus dans un immense océan forestier. Or, ces champignons dégagent toute une gamme de substances volatiles plus ou moins odorantes dont des sesquiterpènes, en partie récupérés du bois consommé. On sait que les coléoptères Ciidés (voir ci-dessus) localisent ces champignons par olfaction, en vol : expérimentalement, si on dispose des carpophores découpés en morceaux, on observe rapidement l’arrivée de ces coléoptères ; même placés hors de la forêt, jusqu’à plus de 1,5km des lisières, cette attraction fonctionne. Ils sont de plus capables de différencier les différentes espèces de polypores selon leurs profils odorants ! Chez le polypore marginé, on a détecté notamment une substance originale, le B-barbatène présent en forte proportion qui attire l’espèce Cis glabratus. La production de substances volatiles évolue en plus selon que le champignon est en activité (libération des spores) ou mort récemment, attirant ainsi des espèces différentes. Ceci explique le fort taux de colonisation des carpophores en dépit de leur extrême dispersion spatiale et dans le temps.
Ainsi le polypore marginé, en colonisant le bois mort, participe d’une part à sa décomposition qui s’inscrit dans le recyclage de la matière organique et d’autre part sert de milieu de vie pour une vaste biodiversité plus ou moins spécialisée. D’où l’importance extrême de conserver une certaine quantité minimale de bois mort dans les forêts exploitées !
Bibliographie
Substrate-specific differential gene expression and RNA editing in the brown rot fungus Fomitopsis pinicola. Wu B, et al. 2018. Appl Environ Microbiol.
Aspects Determining the Dominance of Fomitopsis pinicola in the Colonization of Deadwood and the Role of the Pathogenicity Factor Oxalate. Gerhard Gramss. Forests 2020, 11, 290;
CO-OCCURRENCE PATTERNS OF WOOD-DECAYING FUNGI ON PICEA ABIES LOGS: DOES FOMITOPSIS PINICOLA INFLUENCE THE OTHER SPECIES? Václav POUSKA et al. POLISH JOURNAL OF ECOLOGY 61 1 119–134 2013
VOLATILES OF BRACKET FUNGI Fomitopsis pinicola AND Fomes fomentarius AND THEIR FUNCTIONS AS INSECT ATTRACTANTS. JENNY FALDT et al. Journal of Chemical Ecology, Vol.25, No. 3,1999
Diversity of coleoptera of the bracket fungus Fomitopsis pinicola in a Norwegian spruce forest. KARL H. THUNES et al. Biodiversity and Conservation 9: 833–852, 2000.
Biodiversity in dead wood. J. N. Stokland et al. Ed Cambridge UP. 2012










