Des charançons amateurs de glands : les balanins des chênes
Curculio
11/09/2023 Si vous avez vu (et certainement beaucoup apprécié) le film Le chêne réalisé par M. Seydoux et L. Charbonnier et sorti en salle en 2021, vous avez dû retenir un « acteur » majeur du film qui sert un peu de fil conducteur : un petit insecte aux allures clownesques. C’est un des balanins des glands des chênes (Curculio sp.), des charançons spécialisés dans la consommation des glands aussi bien par les adultes que les larves. Le grand public connaît surtout en général un de leurs très proches cousins, le balanin des noisettes dont les larves rongent les noisettes de l’intérieur (noisettes véreuses).
En France, il existe au moins quatre espèces de balanins des glands des chênes, relativement proches entre elles, et qui cohabitent souvent sur les mêmes chênes. Nous allons ici découvrir le cycle de vie de ces charmants charançons et nous intéresser aux modalités de leur cohabitation entre espèces et avec d’autres consommateurs des glands des chênes.
Pinocchio
Commençons par les adultes, pas faciles à observer car petits (9mm au maximum) et le plus souvent en déplacement dans le feuillage et la ramure des chênes, hors d’atteinte.

Balanin des noisettes : adulte ; noter la fine pubescence 
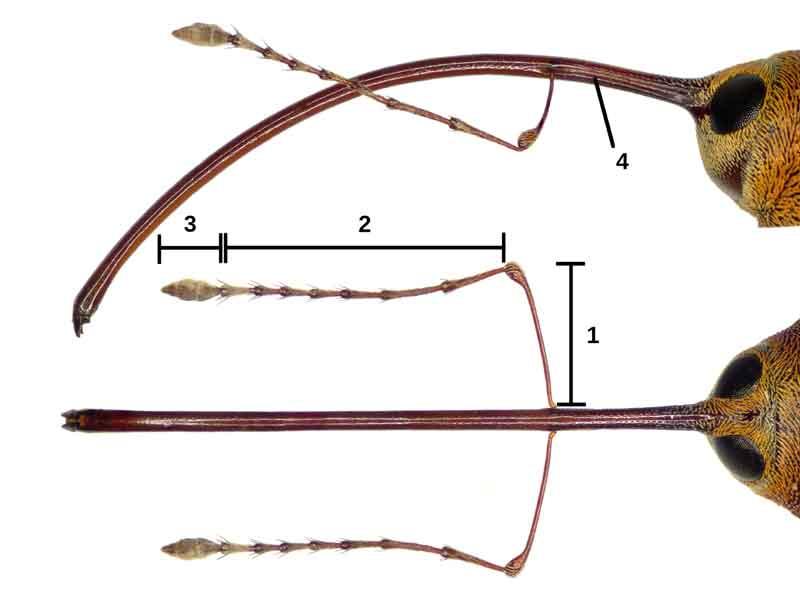
Rostre avec les mandibules au bout et les antennes (repliées) au milieu
Comme tous les charançons, les balanins des glands se distinguent aisément des autres « scarabées » (les Coléoptères) par leur faux-nez : un rostre courbé prolongeant la tête en avant et portant une paire d’antennes coudées à 90°, dont le segment basal se loge dans une gouttière le long du rostre.
Chez les balanins, ce rostre devient démesuré et peut dépasser la longueur du reste du corps. Il résulte de la fusion des pièces buccales très allongées avec, tout au bout, une paire de mandibules dures et coupantes. Contrairement à une idée fausse répandue, ce n’est donc une trompe aspirante mais bel et bien un organe pour découper, mâcher et forer.
Le rostre des balanins possède une originalité absente chez les autres charançons à long rostre comme eux. Chez ces derniers comme chez la majorité des insectes à mandibules coupantes, la paire fonctionne latéralement et donc perpendiculairement au plan de symétrie du corps ; chez les balanins, elle bouge verticalement soit dans le plan de symétrie du corps ce qui leur facilite le travail de forage des glands.
L’observation rapprochée du rostre permet de distinguer les deux sexes : il est plus long chez les femelles ; l’insertion des antennes se fait vers le milieu chez les mâles et en arrière (plus près de la tête) chez les femelles.
Ils sont tous de couleur brun terne et revêtus d’une fine pubescence observable sous la loupe, possèdent des gros yeux implantés à la base du rostre (donnant l’impression de « loucher ») et leurs élytres (la carapace sur le dos) ne recouvrent pas le dernier segment de l’abdomen qui dépasse.
Les balanins des glands se tiennent à la belle saison dans les ramures des chênes sessile et pédonculé (les plus communs) entre autres. Ils peuvent voler en écartant leurs élytres comme les coccinelles (chronique coléoptères) mais se déplacent surtout en marchant et leur rayon d’action reste très limité.
Forage et ponte
Les femelles accouplées partent à la recherche de glands en formation (immatures) dans la canopée d’un chêne : ils vont servir de site de ponte et de nourrissage de la future larve.
Avec son rostre, laborieusement, elle fore un trou à travers la paroi dure du fruit (péricarpe : chronique), puis à travers l’un des gros cotylédons qui constitue l’essentiel de la graine unique. Elle se cale en s’agrippant avec ses pattes assez longues sur la surface du gland et grignote millimètre par millimètre un tunnel à l’intérieur du gland jusqu’à arriver au maximum de son rostre.
Si le gland convient, une fois la galerie forée, elle introduit un (rarement plusieurs) œuf à l’aide de son organe de ponte au bout de l’abdomen, déposé donc au cœur d’un cotylédon charnu. Le trou au point de forage se referme mais laisse en général une petite cicatrice indicatrice de l’effraction mais pas forcément de la ponte : la femelle peut forer le gland et s’en nourrir sans décider ensuite de pondre. Le gland poursuit sa maturation avec l’œuf dans son cotylédon.

Femelle de B. des glands en train de tester un gland pour pondre 
Larve apode 
Larve sortie du gland où elle s’est développée
Deux semaines plus tard, la larve éclot : une sorte de ver blanc sans pattes et sans yeux (d’où l’adjectif véreux, de ver, pour désigner un gland occupé). La larve commence aussitôt à se nourrir en creusant le cotylédon gorgé de réserves nutritives. Elle y reste ainsi, tout en grandissant par mues successives, jusqu’à ce que le gland tombe au sol en se décrochant de sa cupule.

Glands au sol avec le trou de sortie de la larve 
Gland avec le trou de sortie et, sur la cupule, la cicatrice du trou de ponte 
Gland véreux en coupe : les cotylédons sont partiellement rongés
La larve reçoit ainsi le signal qu’il est temps de sortir. Elle fore avec ses mandibules un orifice dans la paroi externe du gland (brune et dure), bien rond mais plus petit que le diamètre de son corps très dodu. Elle tourne sur elle-même et réussit à passer à travers ce trou de souris grâce à son corps mou et flexible.
Une fois au sol, elle s’enfonce un peu et entre en vie ralentie (dormance ou diapause) pour une durée variable selon les espèces et selon l’environnement, allant d’un à cinq ans.
Elle finit par se nymphoser puis éclot pour libérer un adulte. Celui-ci entreprend le plus souvent d’escalader l’arbre sous lequel il est tombé ou, au plus, un autre chêne proche. Les accouplements ont lieu sur l’arbre et les femelles meurent peu après la ponte.
Espèces jumelles
Quatre espèces assez communes de balanins (Curculio sp.) exploitent ainsi les glands des chênes, au moins sur les chênes sessile et pédonculé, les deux espèces de chênes les plus communes dans la plupart des paysages. Comme elles sont très proches d’aspect, on les qualifie d’espèces jumelles dont l’identification requiert un examen rapproché et l’observation de détails sous une loupe ad hoc. De ce fait, leurs noms communs, traduits du nom latin, ont tendance à se répéter et ne sont pas distinctifs en soi. Nous verrons pour autant qu’ils diffèrent nettement dans leur écologie et calendriers de cycle.
Le balanin des glands (C. glandium) diffère des trois autres par son écusson, cette pièce triangulaire coincée en haut de la ligne de jonction des deux élytres, contre le thorax : il est court, pas plus long que large versus plus long que large pour les autres. Il mesure de 4 à 8mm de long et visible d’avril à octobre. Il serait le plus répandu des quatre et parasite aussi les chênes persistants comme le chêne vert.

B. éléphant (cliché F. Pestana ; C.C. 2.0.) 
B des glands (Cliché B. Dupont ; C.C. 2.0.) 
B. rayé (Cliché J. Graham ; C.C. 2.0.)
Le balanin éléphant (C. elephas) se distingue des deux derniers par ses élytres plus allongés et un revêtement dorsal d’écailles uniforme ; il mesure de 6 à 9mm de long et a une répartition surtout méridionale ; il est rare dans l’Ouest. Les adultes s’observent de juin à septembre.
Enfin, il reste les deux espèces « ultra-jumelles » : le balanin rayé (C. venosus) et le balanin poilu (C. pellitus). Tous les deux d’une taille entre 6 et 9mm, ils ne se distinguent que par la forme d’une épine sur la cuisse des pattes arrière (métafémur) : en épine chez le B. rayé et triangulaire chez le B. poilu ! Tous les deux se trouvent sur les chênes à feuilles caduques.
Signalons qu’on peut observer au moins deux autres balanins sur les chênes mais leur cycle n’a pas lieu dans les glands mais dans des galles provoquées par des cynipidés ! il s’agit du balanin à rostre noir (C. villosus), petit (3-4mm) dont les femelles forent les grosses galles ventrues (surnommées pommes de chêne) causées par le cynips Biorhiza pallida et du d’une minuscule espèce (Balanobius pyrrhoceras) (taille 1,3 à 2,2mm !) spécialisée sur les galles du cynips Dryophanta folii en forme de boules dures brunes avec quelques épines.
Fluctuations
Une équipe de chercheurs français a étudié de manière originale (2) comment se passait la cohabitation entre ces quatre espèces qui exploitent la même ressource sur un même arbre.
Ils ont sélectionné deux grands chênes pédonculés, vieux de 150-200 ans, isolés dans la campagne de la région de Lyon et distants l’un de l’autre de 40km. Comme ces charançons semblent avoir une capacité de dispersion très limitée (voir ci-dessus), on peut supposer que tous les charançons autour d’un chêne très isolé appartiennent à une même communauté sans échanges significatifs avec d’autres chênes à proximité. Cette présupposition a été confirmée par une étude génétique de deux populations de B. éléphant sur deux chênes isolés distants de 200m.
Pendant cinq ans, chaque jour de la saison de production des glands (de mi-août à fin décembre), ils ont récolté tous les glands qui tombaient au sol, récupérées dans un filet tendu. Tous les glands récupérés sont mis à incuber et on compte les larves qui en sortent. Ces larves sont mises en condition de se transformer dans des vivariums et on suit l’émergence des adultes. En parallèle de ce fastidieux et remarquable travail de suivi des larves, régulièrement certaines branches des deux chênes choisis sont échantillonnées par battage et récupération dans un filet japonais. Cette opération visant à capturer des adultes en activité et se fait à partir du moment où les premières cicatrices de ponte (voir ci-dessus) sont observées (début juin) jusqu’au moment où plus aucun adulte n’est observé (mi-octobre).
La collecte des glands a confirmé ce que l’on sait depuis longtemps : les chênes individuels ont une production très variable d’une année à l’autre avec une année de production intense, massive, suivie en général d’une à trois années presque sans aucun gland. C’est le phénomène connu sous le nom anglo-saxon de masting.
De ce fait, la ressource en glands constitue un facteur limitant pour ces insectes. Deux résultats confirment cette relation de dépendance étroite : le nombre de larves qui achèvent leur développement sur un arbre est fortement corrélé positivement au nombre de glands produits cette année-là ; la proportion de glands parasités est maximale quand leur production est minimale ou, autrement dit, la probabilité qu’un gland soit véreux du fait de la présence d’une larve de charançon baisse quand le nombre de glands produits augmente, soit les années de très forte production. Ceci implique que la compétition potentielle entre ces quatre espèces serait maximale les années de très faible production de glands.
Décalés
Les résultats (sur cinq ans rappelons-le ce qui renforce la validité des conclusions) montrent une double partition des espèces dans le temps.
D’une année à l’autre, les quatre espèces n’émergent pas (sortie des adultes) de la même manière à l’intérieur de leur cycle de développement (voir ci-dessus). Le B. éléphant émerge durant les deux premières années qui suivent le développement larvaire (phase de dormance) ; le B. des glands émerge massivement, presque exclusivement, la seconde année tandis que les deux autres (rayé et poilu) émergent presque exclusivement au cours de la troisième année de diapause. Ainsi, leurs émergences respectives (sauf es deux derniers) sont asynchrones.
Pour une année donnée, les résultats dévoilent trois stratégies différentes. Les B. rayé et poilu exploitent la ressource glands tôt en saison, tous les deux en même temps sur une courte période. Le B. éléphant intervient nettement plus tard en saison mais là aussi de manière brève. Enfin, le B. des glands s’active sur une période bine plus étendue.
Ainsi, ces quatre espèces co-occurrentes sur la même ressource répondent différemment aux variations marquées dans le temps (masting) de la ressource sauf les deux jumeaux (rayé et poilu) qui semblent synchrones. On a donc deux aspects bien différents dans cette cohabitation à quatre : deux espèces écologiquement très proches (rayé et poilu) et deux nettement décalées (éléphant et des glands).
Subtile répartition
La production massive de glands se produit en général tous les deux à trois ans : ceci doit favoriser le B. des glands et les deux jumeaux. Le B. éléphant est le seul qui émerge sur plus d’un an ce qui le rend sans doute plus apte à coller avec les fluctuations de production en minimisant les risques de manquer de ressource.
La production d’une année donnée dépend d’une part de celle de l’année précédente : par exemple, après une année forte, l’arbre ne peut pas l’année suivante recommencer de même ; ceci est donc relativement prévisible. Mais, d’autre part, d’autres facteurs imprévisibles interviennent comme la météorologie favorable ou pas au printemps au moment de la pollinisation. Ainsi, cette partition dans le temps favorise différentes espèces d’un épisode massif à un épisode sans glands.
La partition au sein d’une année donnée aide aussi à stabiliser cette coexistence entre quatre espèces. Chaque année, on assiste en tout début d’été à une chute massive de glands non fécondés, donc sans graine. De ce fait, les espèces de B. à ponte précoce vont subir un certain échec par apport aux pontes déposées mais inversement seront avantagées les années de faible production où elles accèdent en premier à la ressource. Les espèces à ponte tardive sont plus efficaces quand la production est massive (faible compétition) : elles ont besoin de fruits matures et viables à une période tardive.
Reste le cas particulier des deux jumeaux, les B. rayé et poilu. On ne constate pas de partition dans le temps entre elles aussi bien entre années qu’au sein d’une année (et ce sur deux sites différents ce qui confirme bien la réalité de cette synchronisation inter-espèces). Les mesures du poids frais des larves quand elles sortent des glands pour se nymphoser montre que même là ils sont identiques. Pourtant, une analyse génétique indique qu’ils ne sont pas parents proches, en dépit de leur forte ressemblance physique. On a donc là deux espèces bien différentes qui ont convergé écologiquement en répondant de la même manière aux variations de leur ressource. Étant plutôt favorisés par les années de production massive, ils arrivent ainsi à cohabiter tout en ayant la même écologie !
Balanins mégalos ?
Dans le portrait général, deux traits frappants se sont dégagés : le long rostre courbé (d’où le qualificatif d’éléphant pour une espèce) et les longues pattes relativement au corps trapu et court. Ces deux traits déterminent en fait quels types de fruits/graines ces insectes vont pouvoir consommer et forer de manière à y pondre ; les pattes interviennent dans le positionnement sur le fruit de manière à le surplomber d’assez haut pour commencer à forer avec le long rostre tut en s’agrippant.
Le balanin des camélias a été étudié de ce point de vue et on a découvert que la longueur du rostre variait selon les populations en fonction de l’épaisseur des téguments (enveloppes) des graines exploitées. Une course aux armements coévolutive a conduit au cours du temps à sélectionner des camélias avec des graines aux téguments de plus en plus épais et des balanins au rostre de plus en plus long. Mais chez les balanins des chênes, ce rôle adaptatif du rostre long semble moins clair. Nous avons aussi déjà abordé cette question à propos de l’apion de la rose trémière.
Deux espèces, le B. éléphant et le B. des glands ont ainsi été comparées (3). La taille du rostre est corrélée avec la taille du corps : plus les B. sont grands, plus ils ont rostre long. Les femelles du B. éléphant sont en moyenne plus grandes avec un rostre plus long. La longueur du rostre ne semble pas critique pour traiter les glands : les femelles de B. des glands, plus petites et donc avec un rostre plus court réussissent aussi bien à traiter des glands petits que plus gros. Ainsi, leur niche écologique s’en trouve plus élargie par rapport aux femelles de B. éléphant qui ne peuvent traiter par contre que des gros glands. Par contre, les larves du B. éléphant étant plus grandes, elles ont une meilleure chance de survie finale. Donc le rostre long ne fournit pas un avantage décisif !
Chez le B. éléphant, la taille des glands constitue un critère décisif car sur les petits glands, les femelles ont du mal à se positionner du fait de leurs pattes plus grandes. De plus, la larve plus gourmande peut difficilement atteindre sa taille ultime dans des glands petits. Ceci expliquerait peut-être pourquoi le B. éléphant ne parasite que très rarement les glands du chêne vert (plus petits en moyenne) contrairement au B. des glands. On assiste ainsi à une certaine spécialisation relative de cette espèce ce qui a ses avantages (meilleure exploitation) mais aussi ses risques (dépendance envers une seule ressource qui peut manquer).
Décidément, ces petits charançons ont des histoires de vie bien plus complexes et sans cesse en évolution que ne laisserait croire leur apparence clownesque et débonnaire. Nous n’avons ici abordé que le point de vue des balanins mais qu’en est-il du côté des chênes, « victimes » de leur prédation. Une prochaine chronique sera consacrée à ces relations tumultueuses et tout aussi complexes entre chênes et balanins.
Bibliographie
1)Les balanins du département de la Manche L’ARGIOPE n°36 PRINTEMPS 2002 Yves LE MONNIER Excellent article avec une clé d’identification illustrée et des dessins de très bonne qualité.
2)Coexistence of Insect Species Competing for a Pulsed Resource: Toward a Unified Theory of Biodiversity in Fluctuating Environments Samuel Venner et al. PLoS ONE 2011
3)Complex selection on life-history traits and the maintenance of variation in exaggerated rostrum length in acorn weevils Raul Bonal • Josep Maria Espelta • Alfried P. Vogler Oecologia 2010