Les mouches-à-scie ou tenthrèdes
24/07/2022 Dans la chronique « Les ailes mariées », nous avons présenté l’extraordinaire diversité de l’ordre des Hyménoptères que l’on a tendance à résumer aux seules abeilles, bourdons et guêpes : tant à cause du miel fourni par les premières qu’au dard venimeux dont tous sont dotés (voir la chronique sur les guêpes mal-aimées). Cette vision est très réductrice : d’une part il existe des milliers d’espèces d’abeilles autres que l’abeille domestique qui nous est chère et de même pour les guêpes avec par exemple les guêpes parasites et leur diversité quasiment sans égal. Cette vision anthropocentrée, basée sur le seul critère sur miel/piqûre écarte aussi un grand groupe informel d’hyménoptères : les mouches-à-scie, les symphytes des entomologistes. Très communes et représentées en France par plus de mille espèces, les mouches-à-scie méritent d’être mieux connues et offrent de belles opportunités d’observations et de découvertes de comportements très surprenants. Comme sur les 8500 espèces de Symphytes connues, près de 7400 relèvent de la même superfamille des Tenthrèdes, on prend souvent ce nom comme synonyme de mouche-à-scie.
Fausses-chenilles
Les mouches-à-scie sont tout d’abord bien des hyménoptères : elles affichent le critère décisif des deux paires d’ailes transparentes, appariées entre elles par un jeu de crochets, le système des « ailes mariées » évoqué dans la chronique sur les hyménoptères. Le surnom populaire de « mouches » remonte en fait à une époque ancienne où l’on nommait mouches toutes sortes d’insectes volants à ailes transparentes ; ainsi, on nommait l’abeille domestique mouche-à-miel, le ver luisant (un coléoptère) mouche de feu ou la cantharide (autre coléoptère) mouche d’Espagne.

Tenthrède (Macrophya sp ?) ; noter la coloration type « guêpe » 
Vue de dessus ; noter les éperons aux tibias postérieurs 
Femelle d’une espèce noire à pattes claires ; noter l’absence de taille de guêpe 
Tenthrède (Argidé) vue de dessous : thorax et abdomen forment un seul bloc
Vues de loin, les tenthrèdes peuvent effectivement être confondues avec des « vraies » guêpes notamment par leur coloration souvent vive (voir ci-dessous). Un critère majeur les en distingue dès qu’on les observe de plus près : il n’y a pas de rétrécissement marqué entre le thorax (qui porte les ailes et les pattes) et l’abdomen : elles n’ont pas la « taille de guêpe » qui définit l’immense sous-ordre des Apocrites au sein des hyménoptères (voir la chronique). Cette différence a été retenue pour construire le nom scientifique de ce groupe, Symphytes : il signifie « qui poussent ensemble », sous-entendant que le thorax et l’abdomen sont non séparés. Les pattes des adultes portent de plus des éperons pointus au niveau des tibias.
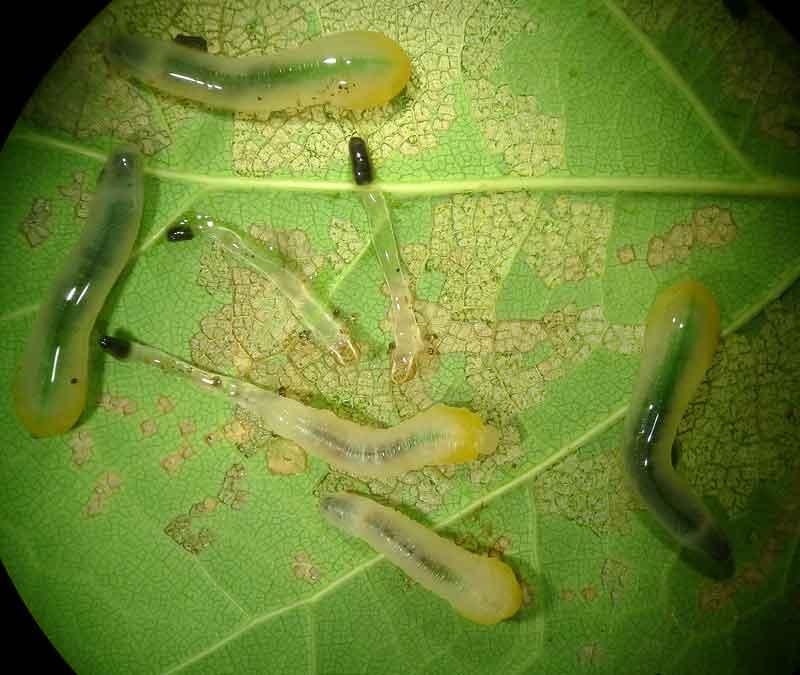
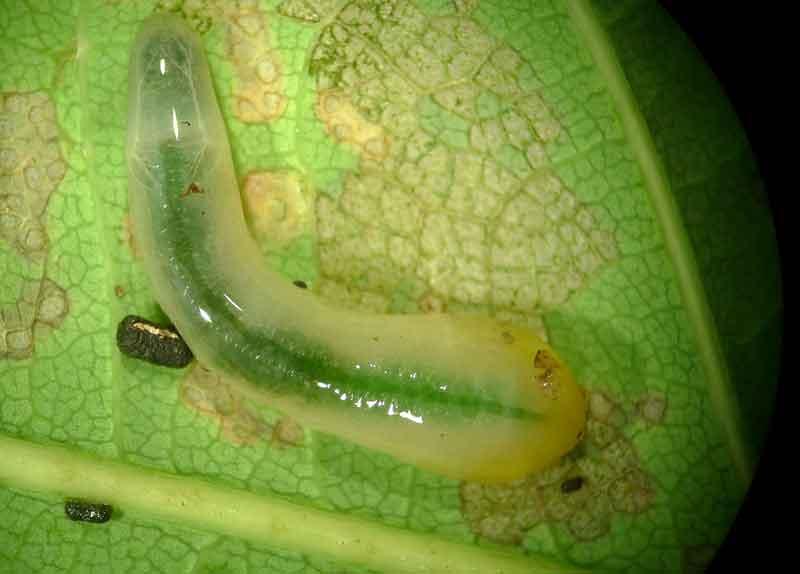
En tant qu’hyménoptères, elles ont un cycle de développement à métamorphoses complètes (œuf/larve/nymphe/adulte) mais leurs larves sont très différentes. Au lieu d’être des asticots vermiformes propres aux apocrites (voir l’exemple des guêpes polistes), leurs larves ressemblent très fortement à des chenilles de papillons : on parle de larves éruciformes (de eruca, chenille). Elles possèdent comme les chenilles trois paires de vraies pattes à l’avant et une série de paires de fausses-pattes (non articulées) abdominales. La ressemblance est telle qu’on les confond très facilement, ce qui participe à occulter les mouches-à-scie. Il faut compter le nombre de paires de fausses-pattes pour les distinguer à coup sûr : au moins six (y compris la paire terminale) chez les mouches-à-scie et jamais plus de cinq pour les chenilles de papillons. Autre détail distinctif mais visible uniquement à la loupe : les fausses-pattes ne portent pas de crochets comme celles des chenilles.

Vue de près, la tête apporte un autre critère : plus « dégagée » que celle des chenilles (à la tête engoncée dans le thorax), elle affiche une seule paire « d’yeux » ou ocelles versus six paires chez les chenilles.

Larve de Cimbex en position enroulée : noter l’ocelle noir unique de chaque côté de la tête 
Larve de tenthrède du millepertuis : noter les nombreuses fausses-pattes
A scie ?
Ce surnom intrigant ne s’applique en fait qu’aux seules femelles dotées d’un organe de ponte ou ovipositeur (voir la chronique sur les hyménoptères) particulier en forme de « scie », i.e. avec des crénelures : il permet à la femelle de forer des tissus végétaux pour y insérer un œuf en laissant une cicatrice. Le site de ponte varie beaucoup mais la plupart pondent sur des feuilles : soit sur les bords, notamment au bout des dents, ou bien près du pétiole ou de la nervure principale. Sinon, elles peuvent aussi, selon les genres, pondre dans des inflorescences (dont les chatons d’arbres), des bourgeons, des brindilles, des aiguilles de conifères, …
Les femelles des Siricidés ou « guêpes du bois », dont le sirex géant, une grande mouche-à-scie (2-4cm de long), possèdent un long et gros ovipositeur: les femelles s’en servent pour percer le bois sur 1 à 2cm de profondeur et y déposer leur œuf ; la larve se nourrit ensuite du bois (xylophage). Elles sont attirées par les bois récemment brûlés, promesse de gîtes favorables. Là encore, en dépit de son aspect impressionnant, cet ovipositeur n’est pas un dard et ces insectes sont inoffensifs.
Ne pas les confondre avec les grands ichneumons (Apocrites parasites) que l’on peut voir eux aussi installés sur un tronc en train de le percer avec leur long ovipositeur très fin comme une aiguille pour déposer leur œuf sur des larves xylophages … dont celles des siricidés.

Cet ovipositeur-scie conduit à un autre critère distinctif des tenthrèdes : leurs larves sont presque toutes végétariennes, se nourrissant de divers tissus végétaux, surtout des feuilles. Souvent, une espèce donnée ou un genre donné ne se nourrit que d’une espèce ou d’un genre de végétaux. Cette relative spécificité transparaît dans les noms communs attribués à ces insectes ; ainsi, on parle de la tenthrède du rosier, ou de celle de l’orme, …

Larve de tenthrède des iris d’eau 
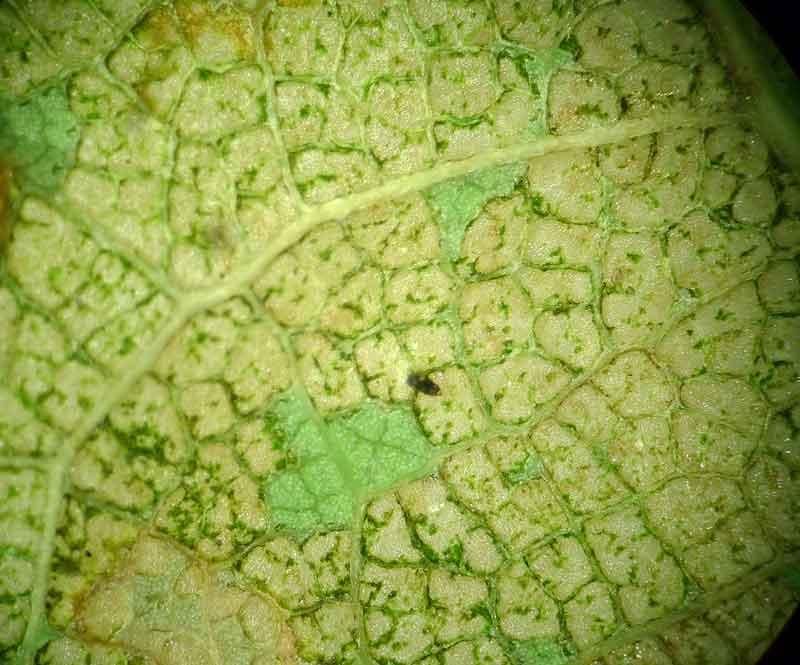
Feuilles attaquées 
Certaines touffes peuvent être entièrement défoliées
D’où l’importance, quand on observe des larves se nourrissant, de bien identifier la plante hôte. Environ la moitié des espèces connues vivent sur des arbres ou arbustes et les autres sur des plantes herbacées ; au moins 170 genres de plantes peuvent être consommés en Europe : plantes à fleurs, conifères, fougères, et même mousses. Quatre familles d’arbres concentrent beaucoup d’espèces de mouches-à-scie : saules et peupliers (Salicacées) ; chênes (Fagacées) ; pruniers, cerisiers, rosiers (Rosacées) ; aulnes et bouleaux (Bétulacées).
Les adultes par contre visitent surtout les fleurs pour y récolter du pollen ou du nectar ou bien capturer de petits insectes ; à ce titre, ils peuvent jouer un rôle dans la pollinisation d’espèces à fleurs généralistes ; ainsi, on peut observer beaucoup de tenthrèdes sur les capitules de diverses Composées ou sur les ombelles des Apiacées ou ombellifères. De rares espèces coupent des nervures de feuilles pour lécher la sève. Certains genres fréquentent les fleurs de la famille des plantes hôtes : ainsi les hoplocampes adultes, dont les larves creusent les fruits des rosacées, butinent les fleurs de ces arbres. Les adultes vivent au maximum deux semaines, juste le temps de se reproduire.

Groupe de tenthrèdes (Macrophya) sur une ombelle de berce ; lieu de rendez-vous pour les accouplements 
Argidés sur une ombelle de berce
Vie larvaire
L’habitat des tenthrèdes dépend évidemment de l’abondance des plantes hôtes de leurs larves ; ainsi, on en trouve facilement dans des zones dominées soit par des salicacées, ou des bétulacées ou des rosacées (voir ci-dessus), y compris dans les parcs ou jardins où l’on peut observer plusieurs dizaines d’espèces. Compte tenu de la peau fine et tendre de leurs larves, elles fréquentent surtout des habitats avec une humidité relativement importante : lisières et clairières fraîches à humides, bords de rivières, marais et bois humides, …
En général, il n’y a qu’une génération par an avec les adultes qui émergent (voir ci-dessous) au printemps ou début d’été pour la plupart. Les femelles pondent rapidement après l’accouplement mais on connaît un certain nombre d’espèces dites parthénogénétiques, i.e. dont les femelles peuvent pondre des œufs viables sans s’être accouplées. Une à deux semaines plus tard, les œufs éclosent et les jeunes larves se mettent tout de suite à consommer les tissus de la plante sur lesquels elles viennent de naître.

Groupe de tenthrèdes (Craesus) : toutes sur le bord de ces feuilles de rejets de tremble 
Après leur passage, il ne reste souvent que les grosses nervures
Il existe une grande diversité de modes alimentaires au sein des tenthrèdes. Sur les feuilles, elles peuvent grignoter les bords en progressant vers l’intérieur ; d’autres se tiennent dessous des feuilles en laissant l’épiderme supérieur ou au contraire dessus en grignotant tout et en ne laissant au final que les nervures comme un squelette. Si elles sont nombreuses, elles peuvent défolier des arbres entiers. D’autres vivent dans des toiles ce qui renfonce la confusion possible avec des chenilles de papillons ou bien roulent des feuilles avec de la soie et se cachent à l’intérieur. Une sous-famille des tenthrèdes (Hétérarthrinés) s’est spécialisée dans la vie larvaire mineuse (voir la chronique sur ce mode de vie) en creusant des mines en plaques sans corridor sur la face supérieure des feuilles. Enfin, certains genres dont Pontania sont gallicoles, i.e. que la ponte des œufs induit la formation d’une galle (voir la chronique sur les galles) notamment sur les saules : sur une même espèce de saule, on peut trouver des dizaines d’espèces différentes, chacune avec son type de galle.
La larve passe par 5 à 6 mues de croissance pour atteindre sa taille maximale. Arrivée à ce stade, elle ne se métamorphose pas de suite en nymphe mais se transforme en un stade immobile qualifié de prénymphe, de type larvaire mais souvent avec forme et coloration très différentes. Ainsi, les larves des Periclista dotées de longues épines sur leur corps les perdent lors du passage en prénymphe. Elle cherche un site de repos : le plus souvent, elle descend au sol ou dans la litière de feuilles mortes et tisse un cocon ou bien se crée une cellule avec des particules de terre. Elle va passer l’hiver ainsi abritée ; au printemps, elle subit la métamorphose finale en vraie nymphe qui va éclore une dizaine de jours plus tard en adulte. Quand il y a plusieurs générations qui se succèdent sur une saison, les cocons sont tissés sur la plante nourricière sauf la dernière génération qui descend à terre.
Défenses chimiques
Ces larves mènent pour la plupart une vie très exposée sur le feuillage des plantes et sont en plus souvent vivement colorées : pour autant, elles disposent entre autres de défenses chimiques remarquables. Deux grands types sont connus chez les larves de tenthrèdes.
Dans la sous-famille des Nématinés, les larves possèdent des glandes ventrales dévaginables qui émettent une substance volatile destinée en premier lieu à repousser les insectes prédateurs et secondairement les oiseaux. Les larves des Cimbex rejettent un liquide défensif par des pores latéraux au-dessus des stigmates respiratoires. D’autres crachent ce liquide par la bouche.

Dans la tribu des Phymatocerines et chez les Athalia, les larves utilisent un procédé inconnu chez les autres insectes : le « saignement facilité » qui diffère de la saignée réflexe utilisée par exemple par les coccinelles ou les crache-sangs (voir la chronique) : la peau se déchire sous l’effet d’un stress mécanique externe en tout point du corps et l’hémolymphe qui suinte (les insectes n’ont pas de sang ni de vaisseaux sanguins) renferme des substances toxiques récupérées lors de la consommation de la plante hôte, très répulsives envers notamment les fourmis et les guêpes. Ainsi, les larves de la tenthrède du navet (Athalia rosae) se nourrissent sur des Crucifères qui produisent des métabolites toxiques puissants, les glucosinolates (voir la chronique sur la bombe M) ; alors que les concentrations dans les feuilles sont inférieures à 1 micromol/gr, celles dans l’hémolymphe des larves atteint 10 à 30 mmol/gr ; comme les crottes n’en contiennent que des traces, cela signifie que la larve stocke ces toxiques ; on les retrouve même dans le corps des adultes ce qui indique une transmission lors de la métamorphose. Ceci explique pourquoi ces larves souvent bigarrées, en groupes parfois nombreux, très exposées, échappent à la prédation.
Défenses physiques
Mais ceci n’est qu’une partie de l’arsenal défensif des larves de tenthrèdes. En complément ou en remplacement des défenses chimiques selon les genres, elles peuvent se protéger via des défenses physiques ou des comportements.
Nombre de ces larves développent des revêtements protecteurs : une pubescence fournie ou des soies ou des épines, une couche secrétée souvent blanche et intégrée dans la peau, parfois des sortes d’efflorescences cireuses (Allantina), voire des longs filaments hérissés comme chez les Eriocampa …
Les larves des Caliroa sont remarquables par leur revêtement de mucus ; ceci leur donne un aspect de petites limaces gluantes en forme de massue qui répandent une odeur d’encre.
On observe aussi de nombreux comportements qui diminuent les risques de prédation. Ainsi, certaines espèces ne se nourrissent que sous les feuilles ou en restant cachées de jour ; d’autres roulent des feuilles et les maintiennent ainsi avec des fils de soie à la manière de nombreuses chenilles de papillons nocturnes. Les larves mineuses ou gallicoles (voir ci-dessus) s’abritent à l’intérieur des tissus foliaires.
Dans la famille des Céphidés, les larves ont des pattes vestigiales qui forent les tiges de plantes herbacées et se trouvent ainsi indirectement protégées.

Larve d’une des tenthrèdes des rosiers (Allantus viennensis) en position de nourrissage 
La même dérangée se roule en boule … ce qui entraîne souvent sa chute
Souvent, quand elles se sentent en danger, elles s’enroulent et se laissent tomber au sol : une mésaventure que connaissent bien les photographes de ces charmantes larves. Les larves de la tenthrède du bouleau (Craesus septentrionalis), très bigarrées (vertes à points noirs) se nourrissent en groupes, bien en vue, sur les bords des feuilles des aulnes, bouleaux et divers autres feuillus. En cas de menace, elles adaptent collectivement un comportement surprenant : elles lèvent leur abdomen brusquement en courbant leurs corps en forme de point d’interrogation ; soit elles se figent dans cette position, soit elles agitent plusieurs fois leur abdomen comme si elles donnaient des coups de fouet. Ce déploiement collectif doit sans doute effrayer les prédateurs tentés par ces proies dodues et si voyantes.
La vie en groupes, de manière contre-intuitive, semble bien être une forme de protection indirecte. Des expériences sur une espèce exotique montrent que le risque de mortalité est supérieur quand les larves sont élevées seules. Ce ne serait pas une histoire de prédation mais un effet sur la thermorégulation : en groupes, les larves maintiennent une température interne plus élevée et grandissent plus vite et mieux, atteignant ainsi un poids supérieur au dernier stade larvaire.
En dépit de toutes ces défenses, les larves des tenthrèdes n’échappent pas pour autant à tous les prédateurs mais surtout subissent de lourdes pertes du fait des insectes parasitoïdes au premier rang desquels des hyménoptères (ichneumons, braconidés, … voir la chronique sur les hyménoptères). Ainsi, les espèces de tenthrèdes mineuses, en dépit de leur protection physique, sont parasitées en moyenne par 8 à 12 espèces de parasitoïdes. Les cocons au sol sont recherchés des petits rongeurs ou des oiseaux.
Chez les adultes, les couleurs vives contrastées qui rappellent souvent celles des guêpes doivent procurer une certaine défense envers les prédateurs selon le principe de l’aposématisme (voir la chronique) ; l’ovipositeur des femelles peaufine d’ailleurs cette ressemblance. De la même manière, les colorations bigarrées de nombreuses larves relèvent sans doute de couleurs dites d’avertissement, signalant qu’elles sont potentiellement toxiques.
Evolution
Les symphytes forment le groupe le plus basal (ou le plus ancien) des hyménoptères. Nous avons vu ci-dessus que la majorité des tenthrèdes ont des larves végétariennes ; en fait ceci concerne 99% des espèces. Sur 7390 espèces végétariennes, la majorité (6265) se nourrit sur des plantes à fleurs ; le reste se partage entre les conifères (140 espèces) ou les fougères (985). Une analyse phylogénétique montre que leur explosion évolutive sur les plantes à fleurs a commencé dès l’origine de celles-ci.
Mais une petite famille (75 espèces dans le monde) de tenthrèdes fait exception à cette règle générale du régime végétarien des larves : les orussidés. Quelques espèces vivent en Europe : de couleur foncée, certaines ont un abdomen rouge faisant penser à des guêpes sphécidés ; mais elles n’ont pas la taille de guêpe comme les autres symphytes.
Elles se distinguent des autres tenthrèdes par leurs antennes curieusement placées en-dessous des yeux, très près des mandibules. Les femelles courent sur les troncs d’arbres morts où elles cherchent à localiser des larves xylophages de buprestes ou de capricornes ou de sirex (voir ci-dessus) : elles tapotent la surface du tronc avec leurs antennes basses pour engendrer des vibrations, lesquelles circulent dans le bois puis reviennent en étant captées par les pattes antérieures. Avec son long ovipositeur cranté, la femelle insère un œuf sur la larve détectée ou dans la galerie ; l’œuf éclot et la jeune larve va se nourrir de son hôte.
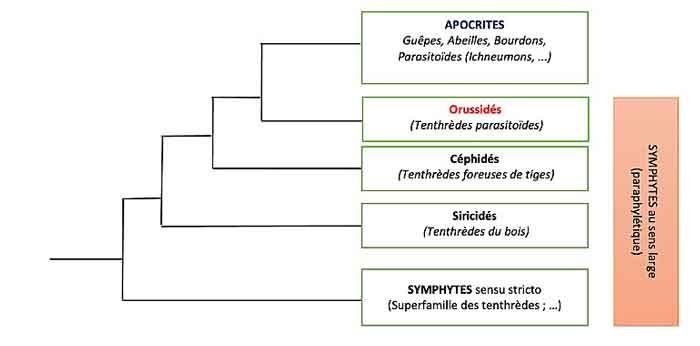
Les analyses phylogénétiques démontrent sans ambiguïté que l’immense groupe des Apocrites (soit tous les autres hyménoptères) partage un ancêtre commun avec cette famille des Orussidés qui a elle-même évolué depuis les autres tenthrèdes (voir l’arbre de parentés). L’acquisition du nouveau mode de vie parasitoïde chez les Orussidés serait le facteur déclencheur clé qui aurait permis ensuite l’explosion extraordinaire des Apocrites avec tout particulièrement les nombreuses lignées parasitoïdes très diversifiées. Le mode de vie parasitoïde suppose l’acquisition d’une série de traits décisifs : la capacité de localiser et d’atteindre les hôtes ; celle d’injecter du venin pour les paralyser, ; anéantir les réponses immunitaires de l’hôte ; se nourrir de chair riche en azote (versus le feuillage pauvre en azote) … Les Orussidés ont acquis quelques-uns de ces traits mais pas tous ce qui expliquerait leur faible succès évolutif : moins d’une centaine d’espèces actuelles versus les centaines de milliers d’apocrites parasitoïdes. Ainsi, leur système de détection par vibrations semble moins efficace que celui développé ensuite par les apocrites ; de même, ils ne paralysent pas l’hôte.
Ainsi les tenthrèdes, grandes oubliées au sein des hyménoptères, méritent bien toute notre attention rien que pour leur rôle évolutif dans l’histoire de ce groupe majeur, peut-être le plus diversifié de tous les insectes et du monde animal. Elles méritent bien plus que l’étiquette de « ravageur » qui leur est accolée systématiquement du fait que certaines espèces peuvent pulluler et devenir ponctuellement un problème. Tapez « larve de tenthrède » sur un moteur de recherche, et presque tous les sites qui s’affichent ne parlent que de cet aspect dont une majorité de sites de jardineries qui proposent leur arsenal destructeur. Il serait urgent de changer de vision du monde vivant : qu’est-ce que ça peut faire que des feuilles des rosiers ou de noisetiers ou autres… soient rongées ; une repousse se fait ensuite. Ce n’est pas beau disent certains mais quid de la beauté de ces magnifiques bestioles. Cessons de dégainer les armes lourdes à la moindre feuille rongée : place au vivant, il y a urgence. Changeons vraiment de point de vue.

Larves de tenthrèdes sur rosier au jardin 
Elles réduisent une partie des feuilles à l’état de squelette ; et alors ???
Bibliographie
Systematics, Life History, and Distribution of Sawflies David R. Smith Sawfly Life History Adaptations to Woody Plants
Invertebrate and avian predators as drivers of chemical defensive strategies in tenthredinid sawflies Boevé et al. BMC Evolutionary Biology 2013, 13:198
Examining potential benefits of group living in a sawfly larva, Perga affinis Lynn E. Fletcher Behavioral Ecology 2009
Evolutionary History of the Hymenoptera Ralph S. Peters et al. Current Biology 27, 1013–1018, April 3, 2017
Sawfly Genomes Reveal Evolutionary Acquisitions That Fostered the Mega-Radiation of Parasitoid and Eusocial Hymenoptera Jan Philip Oeyen et al. Genome Biol. Evol. 12(7):1099–1188 2020