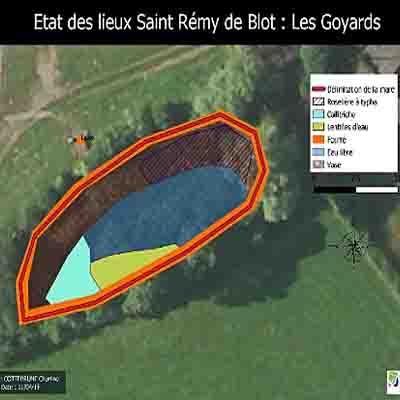
La mare des Gouyards
29/07/ 2022 Dans une récente chronique, j’ai relaté mon nouveau rôle de conservateur bénévole auprès du CEN (Conservatoire des Espaces Naturels) d’Auvergne pour la mare des Chavades à St Myon et commencé à décrire la biodiversité de cette mare communale. A cette occasion, j’ai proposé au CEN de visiter les autres mares des Combrailles gérées par le Conservatoire, notamment pour en dresser l’inventaire botanique, la flore ayant été jusque là peu ou pas prospectée. Je vais donc dans cette série de chroniques Mares des Combrailles rapporter mes découvertes faunistiques et floristiques sur certaines de ces mares au fil de mes visites ; ce sera une manière de faire comprendre à quel point chaque mare est unique de par sa configuration, son histoire, sa végétation dominante, sa gestion, … La série commence donc avec la mare des Gouyards à Saint-Rémy-de-Blot.
Belle mare
Le nom du lieu-dit où se trouve cette mare, les Gouyards, dérive probablement de gouille (ou de la forme masculine moins courante, gouillas), un vieux nom qui remonte au 12ème siècle (sous la forme goille) et désigne un trou d’eau, une mare, une fondrière. Ceci laisse à penser qu’elle doit être ancienne pour avoir ainsi laissé son empreinte toponymique ; pourtant, on n’en retrouve pas trace sur le cadastre napoléonien de 1833. Effectivement, au premier coup d’œil, on pressent qu’il s’agit là d’une mare ancienne comme en attestent les grands arbres qui la bordent, âgés d’au moins 50 ans. Ce rideau de vieux arbres qui ceint presque tout le tour de la mare créé une ambiance très ombragée sur les bords ; ce pourrait être un inconvénient majeur sur une petite mare mais vu sa taille conséquente (600m2), la partie centrale reçoit encore bien le soleil ; autre avantage en ces temps où les canicules se succèdent crescendo : elle a conservé un niveau d’eau assez élevé au cœur de cet été si chaud (mais avec un gros épisode orageux en juin). Alimentée par un fossé, elle s’assèche pourtant facilement en période de sécheresse et sa profondeur moyenne se situe entre 10 et 30cm.
En dépit de sa taille, elle passe inaperçue dans le paysage notamment du fait de ce rideau d’arbres : il faut entrer sur le communal herbeux (avec un remarquable tilleul dit de Sully, pluricentenaire de presque 6m de circonférence) sur le côté droit de la route qui mène au village pour repérer une table de pique-nique sur une plate-forme en bois qui domine la mare. Vous devrez chercher de brèves ouvertures entre ces arbres pour découvrir la mare par petits morceaux.
Roncier refuge
Avant d’entamer l’inspection de la mare proprement dite, j’explore les abords côté communal : un grand roncier broussailleux s’étend sur toute la moitié au-delà de la table de pique-nique : une jungle impénétrable que d’aucuns jugeraient comme « à nettoyer ». Et pourtant, cet espace semi-sauvage forme une zone tampon qui d’une part rend la mare inaccessible de ce côté (donc tranquillité pour les nicheurs) et surtout offre des ressources « alimentaires » et des abris pour une riche biodiversité.
L’élément le plus frappant en cette fin juillet ce sont plusieurs imposantes colonies de menthe à feuilles rondes en pleine floraison. On la surnomme menthe de cheval (sous-entendu pas très bonne au goût comme tisane) ou menthe laineuse (à cause des tiges et feuilles gaufrées couvertes de poils mou crépus) ; cette espèce commune et banale fréquente les sites mouillés en hiver et pouvant s’assécher en été. Elle affiche ses longs épis terminaux coniques de minuscules fleurs blanches à rosées (3-4mm) innombrables ; comme chez les autres menthes, ces fleurs sont régulières (non à deux lèvres) avec un tube ouvert ce qui rend leur abondant nectar accessible à toutes sortes d’insectes non spécialisés : on parle de plante mellifère généraliste.
Et je peux largement attester de cette attractivité : en un quart d’heure de « safari-photo » centré sur les massifs fleuris, j’observe des dizaines d’espèces butineurs. Les mouches dominent par leur nombre et leur diversité : des syrphes éristales (mouches floricoles : voir la chronique) dont les asticots vivent dans l’eau stagnante ; diverses mouches classiques, la plupart aux teintes métalliques : des vertes, des bleues, des rouge violacé, … ; une superbe mouche de la famille des tachinidés aux grands yeux rouges ; …
Les hyménoptères (voir la chronique) ne sont pas en reste : de minuscules abeilles noires et une autre espèce noire plus grande ; un bourdon du groupe terrestre ; un frelon asiatique qui passe en mode « bulldozer » à plusieurs reprises ; … Et puis il y a des dizaines de papillons de jour amaryllis et quelques petits nocturnes dont une jolie pyrale pourpre dont les chenilles se nourrissent de … menthes.
Autant dire que devant une telle diversité dans des groupes eux-mêmes hyper-diversifiés (voir la chronique sur les hyménoptères), il est vain d’essayer d’identifier ces espèces à part une ou deux vraiment reconnaissables de visu. Peu importe qu’ils soient sans nom : ils témoignent de manière superbe de l’importance capitale de ce roncier-friche comme pourvoyeur de nourriture au moins pour des hordes de pollinisateurs. On imagine sans guère se tromper qu’il doit y avoir d’innombrables autres espèces y habitant dont des herbivores comme les sauterelles et criquets sans oublier les prédateurs attirés par cette manne de visiteurs (les toiles d’araignées ne manquent pas).
Et surtout ce havre de biodiversité doit largement profiter aux prédateurs liés à la mare au premier rang desquelles les libellules : si les larves vivent et chassent dans l’eau (voir la chronique), les adultes volent et chassent activement les insectes volants à proximité. Le roncier constitue un terrain de chasse idéal avec en sus des perchoirs par milliers (postes d’affût) et une bonne insolation pour se chauffer au soleil. Les passereaux doivent aussi y trouver leur compte ; les mûres des ronces ne vont pas tarder à être … mûres et seront une bénédiction pour les passereaux en migration ou se préparant à migrer en se gavant pour accumuler des réserves de graisse.
Bref, ce milieu banal, fouillis apparemment sans intérêt, constitue un maillon clé pour épauler l’écosystème mare dont il est étroitement solidaire : les deux sont indissociables.
Rideaux d’arbres
Second écran avant la mare : le rideau d’arbres et arbustes mentionné ci-dessus. On y trouve évidemment en tête les essences liées à l’eau : saules et peupliers (salicacées). Trois espèces de saules se partagent les bords : de nombreux saules cendrés en cépées, quelques saules blancs plus « arbres » et un saule marsault isolé. Dans un angle, d’une vénérable cépée de saule, un énorme tronc, plus gros que ma jambe, s’est abattu en travers de la mare : des dimensions peu courantes de la part de ce saule nettement arbustif : il n’est pas mort pour autant et ce tronc rejette de nombreuses pousses verticales vigoureuses .
Près de la table de pique-nique se dresse un grand peuplier tremble dont le feuillage frissonne sous le vent (voir la chronique) ; autour de lui se dressent de nombreux rejetons issus de rejets sur les racines (drageons).
Un grand noyer surplombe la mare. De l’autre côté, plusieurs grands frênes dominent la scène : cette essence n’est pas strictement dépendante de l’eau mais ne prospère bien que sur des sols bien pourvus. Deux petites bizarreries liées à la proximité du hameau : un jeune pied de laurier-cerise, un amateur de lieux frais qui correspondent à son habitat d’origine dans les Balkans, et un jeune groseillier rouge sans doute dispersé via des excréments d’oiseaux ayant mangé des baies dans un jardin.
L’examen des feuillages de ces arbres et arbustes révèle une biodiversité négligée mais bien réelle : des « galles » sur les feuilles des ronces déformées ou des feuilles repliées sur le saule cendré ; des traces de consommation par des insectes herbivores sur les feuilles de tremble ; des « champignons » parasites de type rouilles (voir la chronique) sur le saule blanc ou sur les ronces.

Feuille de tremble grignotée : par qui ??? 
Galle sur saule cendré : bord de feuille replié et déformé 
Galle sur ronce : Dasineura plicatrix (petite mouche)
Tous ces arbres impactent directement la vie de la mare de diverses manières : par l’ombrage qu’ils projettent qui modifie la température de l’eau et l’évaporation ; par leurs racines qui plongent juste sous la mare et peuvent prélever de grosses quantités d’eau, notamment les saules qui transpirent beaucoup ; par leurs feuilles mortes qui, chaque automne, vont s’accumuler au fond et participer au comblement progressif de la mare. Cet impact mixte explique pourquoi lors des opérations périodiques de gestion, on est amené à en rabattre une partie d’entre eux pour les « calmer » sachant qu’ils rejettent très facilement depuis leur souche et récupèrent en quelques années. Ainsi en 2019, une telle opération avait été menée sur la bordure du communal où nous sommes : il suffit de voir les images d’alors et de comparer avec aujourd’hui pour comprendre la capacité de reprise de ces arbres dont on aperçoit les rejets au bord : seulement quatre ans séparent ces deux paysages.
Dans la typhaie mangrove
Près de la moitié de la surface de la mare est occupée par un peuplement continu et dense de hautes massettes à larges feuilles, ces « roseaux à quenouilles » aux inflorescences en cigares bien connues. Comme dans la mare des Chavades à St Myon (voir la chronique), les massettes tendent à coloniser très vite ces mares au fond riche en matière organique via leur système de rhizome redoutablement efficace. Pour inspecter la mare et dresser l’inventaire de sa flore, je chausse les bottes et je circule lentement entre les pieds de massettes en veillant à respecter le plus possible l’environnement. Attention : ne soyez pas tentés d’en faire autant car tout déplacement dans ce milieu très abrité induit des perturbations sur la faune que l’on piétine et écrase immanquablement.

Feuille rongée (chenille ?) 
Feuille coupée montrant la structure interne faite de lacunes 
Racines plumeuses : de redoutables pompes d’absorption 
Epi fructifière
Je me retrouve ainsi à déambuler entre des hautes tiges qui, pour la plupart, me dépassent d’un bon mètre, ; l’impression d’être perdu au cœur d’une mangrove herbacée. Belle occasion pour considérer au plus près la structure des massettes avec leurs feuilles disposées en éventails, pleines de lacunes aérifères, leurs tiges puissantes, leurs racines fines et plumeuses à peine ancrées sur la vase semi-liquide, … Nombre d’entre elles portent des « cigares brun foncé», les épis femelles fructifiés, composés de milliers de fruits plumeux hyper serrés qui vont se désorganiser à partir de l’automne et être emportés par le vent ; au-dessus, on trouve les restes de l’épi mâle qui a produit les étamines et le pollen ayant servi à la fécondation.
En se déplaçant ainsi à demi enfoncé dans la vase molle, mes yeux se trouvent à hauteur de feuillage ce qui facilite l’observation directe. Très vite, je note de grandes colonies de pucerons minuscules vert clair déjà rencontrés à la mare des Chavades (voir la chronique sur les minuscules) : une espèce banale, le puceron du prunier. Par contre, leur abondance ici est un gage de ressource alimentaire pour divers insectes prédateurs et les petits passereaux comme les pouillots. De nombreuses mouches, tout aussi banales, se chauffent au soleil, posées sur les feuilles plates. Un étrange tonnelet brun collé sur une feuille accroche mon regard : une pupe d’éristale ; ces syrphes pondent dans l’eau stagnante riche en matière organique où se développent leurs asticots « queue-de-rat ».
A contre-jour, une silhouette m’interpelle : une grande araignée brune aux longues pattes ; comme je m’approche, elle s’étire en long, position typique des tétragnathes, araignées typiques des zones humides.
J’atteins le bord de la typhaie et l’eau libre : des remous signalent des « grosses » bêtes ; brève attente et une grosse grenouille verte émerge ; tout autour de grandes plumes flottant sur l’eau ont l’air ( ?) d’être celles d’un héron cendré sans doute venu chasser les grenouilles. L’inventaire antérieur réalisé par le CEN signalait trois autres espèces d’amphibiens dans cette mare : la grenouille rousse, le crapaud commun et le triton palmé.
Safari libellules
Évidemment, les libellules sont au rendez-vous. Quelques délicats agrions bleus se dérobent sans se laisser approcher. Une gracieuse demoiselle au corps d’un délicat vert métallique se pose au sommet d’un typha et se laisse tirer le portrait ; ainsi, je réussis à l’identifier (mais j’attends quand même une confirmation experte) comme étant un leste vert (Chalcolestes viridis) ; elle réunit une série de critères diagnostiques : un long abdomen ; une teinte métallique verte ; des appendices anaux (au bout de l’abdomen de cette femelle) blanchâtres ; ptérostigmas clairs au bout des ailes. Cette espèce a une particularité écologique qui, de plus, colle bien avec le site : elle recherche les mares bordées d’arbres et pond systématiquement dans le bois des branches au-dessus de l’eau. Un superbe mâle rouge de sympétrum se chauffe au soleil : via un expert du site Faune Auvergne j’obtiens la confirmation qu’il s’agit d’un sympétrum sanguin … bien nommé : pattes noires, thorax uniforme, bien rouge, front rouge, abdomen rouge sang légèrement épaissi en massue.
Mais c’est en circulant au cœur de la typhaie que je vais trouver pas moins de quatre exuvies, des peaux vides issues de la métamorphose de larves de libellules lors de l’émergence, i.e. la sortie de l’eau et l’éclosion d’un pré-adulte (voir la chronique). Ce sont toutes des exuvies de « vraies » libellules ou anisoptères (voir la chronique) et de grande taille ce qui exclut les sympétrums observés plus petits ; il y a à coup sûr au moins deux espèces car l’une d’elles est courte et trapue. Il paraît que l’on peut identifier les espèces d’après ces dépouilles : si un expert a envie de s’y attabler, je suis preneur.
Clairement, une telle mare représente un réservoir majeur de biodiversité pour les libellules en offrant à la fois de la nourriture (voir le roncier) et des sites de pontes originaux variés.
Inventaire flore
Le fort ombrage engendré par les arbres et la domination des massettes limitent sérieusement la diversité floristique au niveau de la mare elle-même.
Quelques radeaux flottants visqueux d’algues vertes indiquent une eau chargée en nutriments ce qui n’a rien de surprenant vu l’épaisseur de la vase et la proximité des habitations et des cultures. Une belle mousse vert fluo tapisse la vase entre les pieds de massettes ; il va falloir que je m’y attable cet hiver, quand j’aurai plus de temps, pour l’identifier ; il suffit d’en conserver un échantillon au sec et de le réhydrater le moment venu (voir la chronique sur les mousses). A elle seule, elle représente une belle biomasse végétale.
Je réussis néanmoins à dénicher trois espèces semi-aquatiques, pas rares mais peu communes, installées sur la vase affleurante en bord de mare : le gaillet des marais en petites colonies ; la péplide pourpière typique des grèves vaseuses à peine exondées ; la glycérie aquatique dont on voit de beaux herbiers sur les photos datant de 2019 et maintenant très réduite. En eau plus profonde, on trouve la classique lentille d’eau mineure et des callitriches dispersées ; petite surprise avec quelques feuilles flottantes d’un potamot à feuilles de renouée, typique des eaux acides et peu profondes.
Certes, rien dans cet inventaire (à peaufiner avec des visites à d’autres saisons) n’est extraordinaire ; cependant, à l’occasion de travaux de gestion comme le rétablissement de l’éclairement ou le curage, on peut avoir de belles surprises avec des plantes qui « apparaissent » brutalement : leurs graines ou spores étaient enfouies dans la vase, dormantes, et le retour de la lumière les « réveille » ainsi que le contact avec l’air et une eau plus oxygénée. D’où l’intérêt d’un suivi régulier au fil des saisons et des années.
Bibliographie
Plan de gestion, Mares des Combrailles. Région Auvergne Rhône Alpes. Legrand R., Roig J. ; 2022. 194 pages. CEN Auvergne – Riom