La corée marginée, la punaise des oseilles
Coreus marginatus
03/03/2022 Notre faune compte des centaines d’espèces de punaises ; parmi elles, les plus connues sont sans doute les punaises « à bouclier », les Pentatomidés avec la punaise verte ou les graphosomes (voir la chronique) ou bien les gendarmes (Pyrrhocoridés) (voir la chronique). La corée marginée se distingue par son abondance, sa grande fréquence dans les jardins sur certaines plantes potagères comme la rhubarbe et ses caractères morphologiques qui la rendent assez facile à identifier. Elle ne se cache guère et se laisse très facilement observer et photographier. De plus, elle a fait l’objet d’études approfondies tant sur sa physiologie, son anatomie que sur ses parasites avec des découvertes assez surprenantes.
Coréidé Coréiné Corée
Au sein des punaises (Hémiptères Hétéroptères), la famille des Coréidés qui compte près de 2000 espèces dans le monde et quelques dizaines en France se distingue par un ensemble de caractères : une tête bien plus étroite que le thorax élargi (pronotum) ; deux « taches oculaires » ou ocelles entre les deux yeux composés classiques ; des antennes à quatre segments ; les ailes antérieures sont, comme chez les autres Hétéroptères, des hémélytres ou hémi-élytres ( voir l’exemple des réduves), i.e. qu’ils sont durcis dans leur moitié antérieure ou corie (comme des élytres : voir la chronique sur les Coléoptères) mais membraneux dans leur moitié postérieure et rabattues l’une sur l’autre à plat au repos : mais chez les coréidés, cette partie membraneuse se démarque par la présence de nombreuses nervures saillantes très serrées faisant penser à une aile de samare d’érable (voir la chronique).
La corée marginée réunit effectivement tous ces critères facilement observables. D’une taille moyenne d’un peu plus de 1cm, elle a une coloration très uniforme d’un brun couleur bois, plus ou moins teinté de rougeâtre. Tout le dessus est couvert de minuscules tubercules qui donnent une apparence pointillée. Les bords de l’abdomen nettement élargi dépassent nettement des hémélytres repliés au repos, caractère partagé par d’autres espèces regroupées dans la sous-famille des coréinés. La teinte générale devient plus foncée en fin d’été avant l’entrée en hibernation. Le pronotum, i.e. le « bouclier » qui couvre le thorax se prolonge latéralement par deux angles marqués qui renforcent l’impression d’une toute petite tête en avant. Juste en arrière du pronotum, on remarque un triangle coincé entre les deux hémélytres : le scutellum ou écusson, une pièce durcie que l’on retrouve chez de nombreuses punaises. Les antennes tenues écartées et déployées en avant un peu coudées, ont un article basal large brun foncé, suivi de deux longs articles fins rouges et un article terminal sombre plus arrondi, presque en massue. Enfin, les pattes robustes portent des épines sur la « cuisse ». Si on retourne une corée, on remarque tout de suite une longue pièce qui part de la tête et est maintenu rabattu entre les bases des pattes quand elle n’est pas en action pour se nourrir : ce sont les pièces buccales typiques des punaises, transformées en stylets perceurs et réunis en un rostre piqueur-suceur.
En dépit des apparences de lourdeur, les corées volent très bien ; pour cela, elles écartent leurs hémélytres et déploient leurs ailes postérieures entièrement membraneuses cachées dessous. A l’envol, sous l’hémélytre, une protrusion arrondie glisse sans friction en quelques millisecondes sur le rebord lisse et aplati de l’aile postérieure et s’enclenche avec celui-ci verrouillant ainsi les deux ailes et renforçant la stabilité mécanique.
Ne pas confondre
Au moins trois espèces de coréidés peuvent être confondues avec la corée marginée car elles partagent la même forme du corps et une teinte uniforme terne.

Corée bateau 
Corée bateau : 2 pointes à l’extérieur des antennes 
Corée marginée : 2 pointes entre les antennes
La plus proche est la corée bateau (Enoplops scapha) : de même taille, elle se distingue par une teinte plus grise et sombre, des taches blanches contrastées sur les côtés de l’abdomen ; un critère décisif permet de la distinguer à coup sûr mais il suppose de la prendre en main et de l’observer à la loupe à main (aucun risque !) : il y a deux petites cornes de chaque côté des antennes (côté extérieur) alors que chez la corée ces « cornes » se trouvent entre les antennes ! Elle est nettement moins commune mais répandue et le plus souvent isolée.
Le syromaste en losange (Syromastus rhombeus) est plus petit, dans les mêmes tons brun clair mais se démarque par son abdomen très élargi en deux angles saillants qui dépassent nettement, donnant cete forme losangique bien particulière. La punaise du buis (Gonocerus acuteangulatus) a un abdomen étroit qui déborde à peine sur les côtés et une teinte plus rousse avec des antennes entièrement claires ainsi que les pattes jaunâtres ; elle est commune mais ne se rencontre pas en groupes.
Les américains donnent aux coréidés un nom étrange de premier abord : punaises aux pieds en feuille (leaf-footed bug) ; dans leur faune, les espèces dominantes sont du genre Leptoglossus dont un segment des pattes arrière est élargi en « raquette » en forme de feuille ; il se trouve qu’une espèce nord-américaine, la punaise des conifères (voir la chronique) s’est naturalisée en Europe où elle est désormais très commune et s’observe souvent dans les maisons où elle se réfugie en automne.
Végétarienne
Comme les autres membres de sa famille, la corée marginée est strictement végétarienne : elle prélève des sucs nutritifs en plantant son rostre dans les tiges ou, plus souvent, dans les graines. Les adultes présentent une nette préférence pour les plantes de la famille des Polygonacées : oseilles et patiences (Rumex), renouées (Polygonum) et rhubarbes (Rheum). Ceci explique le nom anglais de cette espèce : dock bug, soit la punaise des patiences (et pas la punaise des docks !). On peut ainsi observer des groupes comptant des dizaines d’individus sur un seul pied de rhubarbe dans les jardins potagers au printemps et en été. Si les immatures en développement (voir ci-dessous) semblent effectivement assez strictement inféodés à ces plantes, les adultes se montrent nettement plus éclectiques (polyphages) et s’observent sur une large gamme de plantes d’autres familles dont des astéracées : cirses, chardon aux ânes (voir la chronique), chardons, bardanes, laiterons, … Au jardin, on les observe aussi souvent installées sur les baies de groseilliers et de framboisiers ou, dans la nature, sur les mûres. Elles se nourrissent sur les parties aériennes, surtout les inflorescences en maturation et les graines ou fruits. Les très jeunes individus se nourrissent d’abord sur les tiges et feuilles puis se concentrent sur les graines au cours de leur développement. Du fait de ce régime globalement généraliste, la corée se rencontre dans toutes sortes de milieux secs à humides disposant d’une végétation herbacée bien développée avec de grandes plantes.
Dans la nature, elle montre, parmi les polygonacées, une préférence pour les patiences sauvages (Rumex obtusifolius), une espèce très commune et souvent envahissante dans les pâturages (voir la chronique). On a donc pensé utiliser les corées dans le cadre de programmes de lutte biologique, notamment dans des pays où la patience a été introduite et se montre très agressive. Les suivis montrent que la prédation exercée par les corées ne diminue pas la masse des graines mais par contre réduit les pourcentages de graines capables ensuite de germer ce qui affecterait un peu la reproduction. Le potentiel d’action des corées semble limité en dépit de leurs populations souvent très denses.
Des expériences ont été conduites pour déterminer comment les corées sélectionnent les graines dont elles se nourrissent de manière préférentielle. On neutralise (en déposant un revêtement chimique) soit les yeux composés, soit les antennes ou soit le labre, pièce buccale associé au rostre ; on propose à ces individus trois sortes de graines soit d’espèces régulièrement consommées (renouée des oiseaux et oseille à grandes feuilles), soit d’une espèce non consommée (stellaire) mais de taille et couleur équivalente. On constate que, quel que soit l’organe sensoriel neutralisé, les corées sucent bien plus vite les graines y compris celles de stellaires normalement non consommées. Tout indique qu’elles ne discriminent plus les différentes graines bien qu’à chaque fois elles n’aient qu’un organe sensoriel neutralisé à la fois. La reconnaissance des graines semble donc se faire via trois sens associés : la vue avec les yeux composés ; le toucher et l’odorat avec les sensilles (voir la chronique sur les antennes des insectes) concentrées sur le segment terminal des antennes ; sans doute le goût avec les poils sensoriels portés par le labre.
Cycle
Au printemps en avril, les adultes émergent de l’hibernation passée sous des débris de végétaux au sol. Ils commencent à se nourrir et à se rassembler sur des plantes nourricières au feuillage en pleine croissance comme les rhubarbes au jardin. Les accouplements ne tardent pas à suivre avec la position typique propre aux punaises, dos à dos, en tandems restant longuement accolés. Fin avril, début mai, les femelles pondent jusqu’à une centaine d’œufs au sol.
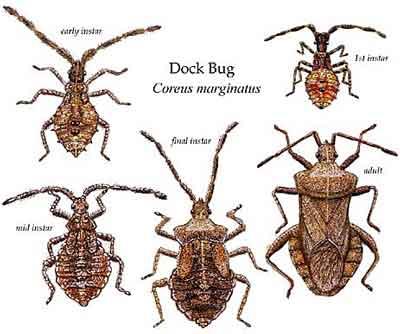
L’éclosion suit trois à quatre semaines plus tard : des œufs émergent de petites bêtes à la fois assez différentes des adultes mais en même temps ayant bien l’allure d’une punaise. Il s’agit donc d’insectes dits hétérométaboles à métamorphoses « incomplètes » ; on ne parle donc pas de larves (voir le cas des Coléoptères) mais d’immatures ; les anglais emploient le terme de nymph pour les désigner mais, en français, la traduction en nymphe est réservée au stade immobile entre les larves et les adultes chez les insectes à métamorphoses complètes. Les immatures qui éclosent portent bien les antennes écartées à quatre segments, l’abdomen élargi (mais aux bords épineux !), la tête étroite mais les ailes sont complètement absentes ; ils portent au début quelques taches colorées rougeâtres. Ces immatures vont subir progressivement une série de cinq mues de croissance au cours desquelles on voit apparaître les ailes d’abord sous formes d’ébauches courtes. Le corps se transforme progressivement : les épines disparaissent de l’abdomen et le pronotum s’élargit.
La maturité complète après la cinquième mue est atteinte dans le mois d’août. Ce long cycle progressif fait que l’espèce n’a qu’une génération par an (monovoltine). Les adultes issus de cette génération ne s’accouplent pas mais vont hiberner et donc émerger au printemps suivant.

Immature au 3ème ou 4ème stade : noter les ébauches alaires 
Immature stade 1 : noter les deux glandes saillantes sur le dos
Mâles et femelles sont très proches d’aspect mais les premiers sont sensiblement plus petits et ont des antennes plus longues.
Capacités cachées
La corée, en dépit de son modeste aspect, possède plusieurs dispositifs anatomiques qui lui confèrent certaines capacités originales. Comme les autres punaises coréidés, elle possède des glandes odorifères qui s’ouvrent par une paire d’ouvertures (ostioles) avec une surface d’évaporation, placées sur les côtés du thorax entre la seconde et la troisième paire de pattes. Elles sont reliées par un canal à un réservoir interne qui stocke des substances chimiques volatiles irritantes et malodorantes libérées en cas de danger. Elles ont donc une fonction répulsive de défense mais servent aussi sans doute dans la communication entre individus. En effet, si mâles et femelles produisent peu ou prou les mêmes substances (une bonne quinzaine de molécules différentes), la composition de leurs émissions odorantes diffère par le composé dominant : l’acide hexanoïque à odeur de fromage voire de bouc chez les mâles; l’acide stéarique chez les femelles (acide gras très commun). A noter que les immatures possèdent déjà ces glandes odorifères mais elles se trouvent sur le dos de l’abdomen sous forme de deux boutons saillants ; au cours de la dernière mue, elles migrent vers le thorax !
On est frappé de la facilité avec laquelle ces punaises grimpent le long des tiges très lisses des plantes nourricières. Au bout des pattes, en plus des griffes, elles possèdent des sortes de boules, les pulvilli qui assurent l’adhésion au support, comme chez les mouches par exemple. Sous chaque pulvillus, il y a des pores par où s’écoule un liquide adhésif secrété de l’intérieur via des canaux sur une surface spongieuse ; le dessus est canaliculé avec des crêtes à cuticule épaisse et des creux très minces ; cette surface plissée renforce la surface de contact car en se dépliant elle aplatit le pulvillus qui conserve son volume. Ce dispositif élaboré est apparu indépendamment dans des lignées différentes d’insectes.
Enfin, les corées émettent des signaux sonores vibratoires inaudibles par l’oreille humaine mais enregistrables via les plaques rigides qui composent leur carapace externe. Les mâles émettent deux types de signaux : des signaux courts (300-400ms) en présence des autres mâles ou quand ils sont seuls ; en présence des femelles, ils émettent des signaux plus longs (1100ms) comme parade avant l’accouplement.
Parasites très énervés !
Comme tous les insectes, les corées renferment dans leur corps divers microorganismes notamment dans leur tube digestif. Certains sont des bactéries symbiotiques bénéfiques mais on y trouve aussi nombre de parasites. Les plus surprenants, à divers titres, sont des trypanosomes, surtout connus par les espèces qui causent de graves maladies humaines. Ces organismes sont des unicellulaires dotés d’un ou deux flagelles et parasites obligatoires d’animaux très divers ; leurs cycles de vie très complexes alternent des formes cellulaires différentes et se déroulent soit au sein d’un seul hôte (espèces monoxènes) ou dans deux hôtes (dixènes) comme Trypanosoma brucei responsable de la maladie du sommeil chez l’homme avec comme hôte intermédiaire et vecteur la mouche tsé-tsé. Au moins deux espèces avec des cycles très différents ont été repérées et étudiées chez les corées.
La première, Blastocrithidia raabei, a un cycle monoxène dans le tube digestif des corées. Or, cette punaise possède un intestin moyen très armé contre les infections microbiennes avec une région rétrécie faisant office de barrière entre deux segments : un antérieur dédié à la digestion et l’absorption et un postérieur où se trouvent les bactéries symbiotiques. Cette barrière réfractaire provoque un comportement anormal de ce parasite : les scientifiques qui l’ont étudié disent qu’il « est fou furieux devant cette résistance » ! Les trypanosomes s’acharnent sur la barrière de cellules épithéliales en s’accumulant et finissent par la dégrader et permettent ainsi la progression vers la partie postérieure ; là, ils produisent des cystes en amas évacués par l’intestin terminal. Ils réussissent cette « percée » via des équipements cellulaires adaptés (« rostre » élargi et appareil de Golgi complexe). On connaît une autre espèce proche (B. papi) qui parasite de même les gendarmes où elle se développe dans les tubes de Malpighi (organes excréteurs) reliés au tube digestif. La transmission se fait au moment de la ponte des œufs par contact avec les excréments chargés de cystes. Le comportement très agressif de ces trypanosomes en fait de bons candidats dans le cadre de programmes de lutte biologique contre des espèces invasives ou bioagresseurs de cultures.
La seconde espèce, Phytomonas lipae, a un cycle à deux hôtes : la corée et, de manière inattendue, une plante qui sert d’intermédiaire ! Ces trypanosomes se développent dans la partie antérieure de l’intestin moyen et, de là, ils passent dans l’hémolymphe, le liquide qui baigne les cavités internes du corps des insectes (qui n’ont pas de système circulatoire clos) ; ils ne cherchent donc pas à franchir la fameuse barrière qui énerve tant leur confrère ! De là, ils rejoignent les glandes salivaires où ils prolifèrent et se transforment : quand la corée pique une plante, elle transmet ainsi le parasite que l’on retrouve dans la sève élaborée (voir la chronique) et dans les fleurs et graines.
Bibliographie
Hémiptères de France. R. Garrouste. Guide Delachaux et N. 2015
How granivorous Coreus marginatus (Heteroptera: Coreidae) recognises its food S. Pekár . M. Hrušková Acta Ethol (2006) 9: 26–30
Attachment devices and the tarsal gland of the bug Coreus marginatus (Hemiptera: Coreidae)Manuela Rebora et al. Zoomorphology (2021) 140:85–102
Vibratory Signals of Two Species of Bugs from the Family Coreidae (Heteroptera). L. S. Shestakov Moscow University Biological Sciences Bulletin, 2009, Vol. 64, No. 1, pp. 49–50.
If host is refractory, insistent parasite goes berserk: Trypanosomatid Blastocrithidia raabei in the dock bug Coreus marginatus. Frolov AO et al. (2020) PLoS ONE 15(1): e0227832.
Development of Phytomonas lipae sp. n. (Kinetoplastea: Trypanosomatidae) in the true bug Coreus marginatus (Heteroptera: Coreidae) and insights into the evolution of life cycles in the genus Phytomonas. Frolov AO et al. (2019) PLoS ONE 14(4): e0214484.